题目内容
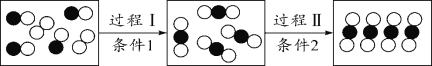
【题目】在化学课上,甲同学将燃烧的钠迅速伸入到盛有CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上粘附着白色物质。
(提出问题)黑色颗粒和白色物质是什么?
(进行猜想)甲认为黑色颗粒是________,白色物质可能是Na2O或________或________,乙同学还认为白色物质是氢氧化钠。
甲同学立刻认为乙同学的猜想是错误的,其理由是____________________________。
(查阅资料)氧化钠为白色粉末,溶于水生成氢氧化钠:Na2O+H2O===2NaOH
(实验探究)甲同学对白色物质进行实验探究。
实验方案 | 实验操作 | 实验现象 | 结论 |
方案1 | 取样品少量于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色醉酞试液 | 溶液变成红色 | 白色物质为Na2O |
方案2 | ①取样品少量于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCI2溶液 | 出现白色沉淀 | 白色物质是_____ |
②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显现象 |
(反思评价)丙同学认为方案1得到的结论不正确,其理由是________________。
(得出结论)钠在二氧化碳中燃烧的化学方程式为___________________________。
【答案】炭(C) Na2CO3 Na2O、Na2CO3 反应物中无氢元素(或违背质量守恒定律,答案合理即可) Na2CO3 Na2CO3溶液显碱性也会使酚酞变红 4Na+3CO2![]() 2Na2CO3+C
2Na2CO3+C
【解析】
根据题干中信息可知,钠与二氧化碳中发生了反应生成一种黑色物质和一种白色物质;其中由于反应物含有钠元素、碳元素、氧元素,那么生成的物质也必须是含有这几种元素,那么黑色固体物质只能是炭,白色物质是什么?根据后面的实验结论和现象可猜到白色物质只能是Na2CO3,根据化学中质量守恒,决不可能是氢氧化钠,因为反应物中无氢元素;根据氢氧化钠、氧化钠和碳酸钠的性质可知,钠在空气中燃烧生成碳酸钠和炭.
(1)【进行猜想】
根据所学过的黑色物质:炭、二氧化锰、四氧化三铁、生铁和氧化铜中可以推测出应该是炭,若其他物质都违背化学反应的事实。
由后面方案2可推测白色物质还可能是碳酸钠或者碳酸钠和氧化钠的混合物;但不可能是氢氧化钠,反应物中没有氢元素;
(2)【实验探究】碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠。
①取样品少量于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液②静置片刻,取上层清液于试管中,滴加无色酚酞试液,
生成沉淀,酚酞不变色,说明只有碳酸钠。
(3)【反思评价】由于碳酸钠溶液也是呈现碱性,所以法案1不可靠;
(4)【得出结论】由方案2得出钠和二氧化碳反应生成碳酸钠和炭,故化学方程式4Na+3CO2![]() 2Na2CO3+C。
2Na2CO3+C。

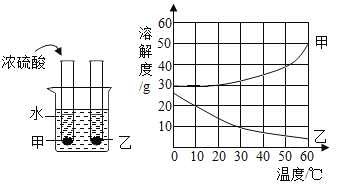
【题目】氯酸钾在工业上用于制造焰火、漂白剂等,在实验室可用于制造氧气。工业上利用石灰浆制备氯酸钾的流程是:

(1)写出实验室用氯酸钾制取氧气的化学方程式____________________。
(2)在实验室里,“操作a”中需要用到玻璃棒,其作用是__________。
(3)“反应1”的化学反应方程式为:6Ca(OH)2+6Cl2=Ca(ClO3)2+5CaCl2+6X,Ca(ClO3)2的名称是__________,X的化学式为__________。
(4)下表是有关物质常温下的溶解度。
物质 | KCl | CaCl2 | KClO3 | Ca(ClO3)2 |
溶解度/g | 34.2 | 74.5 | 7.3 | 209.0 |
“反应2”为复分解反应,参看表中溶解度,写出该反应的化学方程式__________。
(5)上述石灰浆可由电石(CaC2)与水反应制得。现有某电石渣,其中含氢氧化钙92.5%,用该电石渣处理含硫酸49Kg的酸性废水(假设电石渣中的杂质、废水中其他成分均不参加反应),需要电石渣的质量是__________kg。
【题目】某班学生在老师指导下探究铁与水蒸气的反应。
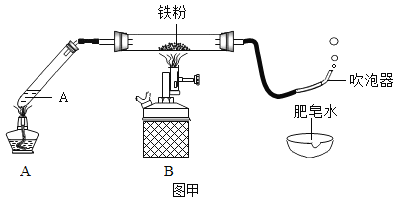
(1)按图甲装好药品、连好装置(夹持仪器已略去)。其中A装置的作用是______。
(2)加热一段时间后,灰色铁粉逐渐变黑,吹泡器连续吹出气泡,且气泡向上飞起;用燃着的木条靠近气泡,能产生爆鸣。该气体燃烧的化学方程式是_______。
(3)同学们讨论后认为:铁与水蒸气反应生成的固体是“铁的一种氧化物”,玻璃管内的黑色固体中还可能含有“过量的铁”。
(查阅资料)铁有三种氧化物,FeO(黑色、无磁性)、Fe2O3(红棕色、无磁性)、Fe3O4(黑色、有磁性);铁的三种氧化物都不与硫酸铜溶液反应。
(实验探究)
实验步骤 | 实验现象 | 实验结论 |
①取上述黑色固体少许,装入试管,加入足量硫酸铜溶液 | 有红色固体出现 | 黑色固体中一定含有______ |
②过滤第①步的产物,将所得固体干燥,用磁铁接触该固体 | 固体可以被磁铁吸起 | 黑色固体中一定含有_______ |
(探究结论)铁与水蒸气发生置换反应,有关的化学方程式是_______。
(拓展创新)同学们利用微型仪器“长柄V形玻璃管”改进了图甲装置,设计出图乙装置,并分别选用湿棉布、湿粉笔、芦荟叶、氢氧化铜等作为供水剂,实验都获得成功。
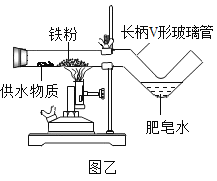
①甲、乙装置相比,乙装置有很多优点,请你写出一条。_____。
②用化学方程式解释氢氧化铜供水的原理:______。
(4)某磁铁矿石含Fe3O480%。若冶炼336t铁,则理论上需该铁矿石多少吨?_____