题目内容
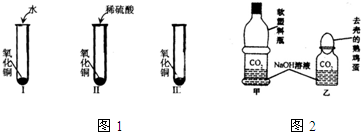
 氧化铜是一种黑色固体,可溶于稀硫酸.某同学想知道稀硫酸中的哪种粒子能使氧化铜溶解.请你和他一起通过如图所示的Ⅰ、Ⅱ、Ⅲ三个实验完成这次探究活动.
氧化铜是一种黑色固体,可溶于稀硫酸.某同学想知道稀硫酸中的哪种粒子能使氧化铜溶解.请你和他一起通过如图所示的Ⅰ、Ⅱ、Ⅲ三个实验完成这次探究活动.(1)你提出的假设是
可能是H+使CuO溶解
可能是H+使CuO溶解
.(2)你通过实验I可以证明
水分子不能使氧化铜溶解
水分子不能使氧化铜溶解
.(3)探究结果为
稀硫酸中的氢离子能溶解氧化铜
稀硫酸中的氢离子能溶解氧化铜
.(4)你认为除实验Ⅱ外,还能够溶解氧化铜的一种物质是
稀硝酸
稀硝酸
.分析:(1)稀硫酸中存在三种粒子,即水分子、氢离子、硫酸根离子,据此进行分析解答.
(2)实验I中加入的是水,实验I是验证水能否使氧化铜溶解.
(3)实验I、实验III中的氧化铜不溶解,II中氧化铜溶解,据此进行分析解答.
(4)根据氧化铜能溶于酸进行分析解答.
(2)实验I中加入的是水,实验I是验证水能否使氧化铜溶解.
(3)实验I、实验III中的氧化铜不溶解,II中氧化铜溶解,据此进行分析解答.
(4)根据氧化铜能溶于酸进行分析解答.
解答:解:(1)稀硫酸中存在水分子、氢离子、硫酸根离子,可能是稀硫酸中的水分子、氢离子或硫酸根离子中的一种使氧化铜溶解.
(2)实验I中,氧化铜不溶解,说明水分子不能使氧化铜溶解.
(3)实验I、实验III中的氧化铜不溶解,说明水分子、硫酸根离子不能使氧化铜溶解.
由题意,氧化铜是一种黑色固体,可溶于稀硫酸;II中氧化铜溶解,说明稀盐酸中的氢离子使氧化铜溶解.
(4)根据所学知识可以判断稀硝酸等也可以使氧化铜溶解.
故答案为:(1)可能是H+使CuO溶解;(2)水分子不能使氧化铜溶解;(3)稀硫酸中的氢离子能溶解氧化铜;(4)稀硝酸等.
(2)实验I中,氧化铜不溶解,说明水分子不能使氧化铜溶解.
(3)实验I、实验III中的氧化铜不溶解,说明水分子、硫酸根离子不能使氧化铜溶解.
由题意,氧化铜是一种黑色固体,可溶于稀硫酸;II中氧化铜溶解,说明稀盐酸中的氢离子使氧化铜溶解.
(4)根据所学知识可以判断稀硝酸等也可以使氧化铜溶解.
故答案为:(1)可能是H+使CuO溶解;(2)水分子不能使氧化铜溶解;(3)稀硫酸中的氢离子能溶解氧化铜;(4)稀硝酸等.
点评:本题有一定难度,掌握酸溶液和氧化铜反应的本质(是溶液中的氢离子和氧化铜反应的结果)并能灵活运用是正确解答本题的关键.

练习册系列答案
 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目
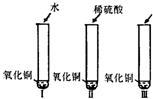 28、氧化铜是一种黑色固体,可溶于稀硫酸.某同学想知道是稀硫酸中的哪种粒子(H+、SO42-、H2O)能使氧化铜溶解,请你帮他通过下图中的三个实验完成探究活动.
28、氧化铜是一种黑色固体,可溶于稀硫酸.某同学想知道是稀硫酸中的哪种粒子(H+、SO42-、H2O)能使氧化铜溶解,请你帮他通过下图中的三个实验完成探究活动. 21、氧化铜是一种黑色固体,可溶于稀硫酸:某同学想知道是稀硫酸中的哪种粒子(H2O、H+、SO42-)能使氧化铜溶解.请你和他一起通过下图I、II、III三个实验完成这次探究活动.
21、氧化铜是一种黑色固体,可溶于稀硫酸:某同学想知道是稀硫酸中的哪种粒子(H2O、H+、SO42-)能使氧化铜溶解.请你和他一起通过下图I、II、III三个实验完成这次探究活动. 氧化铜是一种黑色固体,可溶于稀硫酸.某同学想知道是稀硫酸中的哪种粒子(H+、SO42-、H2O)能使氧化铜溶解,请你帮他通过下图中的三个实验完成探究活动.
氧化铜是一种黑色固体,可溶于稀硫酸.某同学想知道是稀硫酸中的哪种粒子(H+、SO42-、H2O)能使氧化铜溶解,请你帮他通过下图中的三个实验完成探究活动.