题目内容
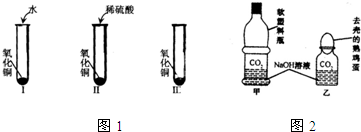
 氧化铜是一种黑色固体,可溶于稀硫酸.某同学想知道是稀硫酸中的哪种粒子(H+、SO42-、H2O)能使氧化铜溶解,请你帮他通过下图中的三个实验完成探究活动.
氧化铜是一种黑色固体,可溶于稀硫酸.某同学想知道是稀硫酸中的哪种粒子(H+、SO42-、H2O)能使氧化铜溶解,请你帮他通过下图中的三个实验完成探究活动.(l)你提出的假设是
可能是H+使CuO溶解
可能是H+使CuO溶解
.(2)通过实验Ⅰ可证明
水不能溶解CuO
水不能溶解CuO
.(3)要证明另外两种粒子能否溶解氧化铜,还需要进行实验Ⅱ和实验Ⅲ,在实验皿中应加入
Na2SO4
Na2SO4
(4)探究结果为
稀H2SO4中的H+溶解CuO,H2O和SO42-不能溶解CuO
稀H2SO4中的H+溶解CuO,H2O和SO42-不能溶解CuO
.(5)请写出氧化铜与稀硫酸反应的化学方程式:
CuO+H2SO4═CuSO4+H2O
CuO+H2SO4═CuSO4+H2O
.分析:根据所学知识,学生知道稀硫酸中存在H+、SO42-、H2O三种粒子,提出假设并不困难,一般都知道应是三种粒子中的某一种使CuO溶解.关键是通过三组不同实验,根据不同的现象进行分析、对比得出是H+使CuO溶解的结论.题目中的Ⅰ实验证明了H2O不能使CuO溶解的结论,实验Ⅱ中既有H+,又有SO42-和H2O,其中水分子已经证明了不能使CuO溶解,因此实验Ⅲ就应该考虑单独含有H+或SO42-的物质和CuO反应,观察CuO是否溶解,所以实验Ⅲ中应加入的物质可以是稀盐酸或硫酸钠溶液,还能溶解CuO的另一种常见物质是硝酸或盐酸.
解答:解:(1)根据所学知识,学生知道稀硫酸中存在H+、SO42-、H2O三种粒子,提出假设并不困难,一般都知道应是三种粒子中的某一种使CuO溶解,所以可以假设使氧化铜溶解的可能是氢离子;
(2)因为现象是氧化铜不溶解,所以结论是水分子不能使氧化铜溶解.
(3)因为Ⅰ实验证明了H2O不能使CuO溶解的结论,实验Ⅱ中既有H+,又有SO42-和H2O,其中水分子已经证明了不能使CuO溶解,而且知道实验Ⅱ中的现象是氧化铜溶解,但三个实验必须得出实验结果,所以实验Ⅲ中应加入的物质应该是含硫酸根的溶液,进而排除硫酸根是否能溶解氧化铜的结论.
(4)通过实验可以得知,水分子和硫酸根离子都不能使氧化铜溶解,使氧化铜溶解的是氢离子,只有含有大量氢离子的溶液才可以和氧化铜反应使之溶解,所以结论是:稀H2SO4中的H+熔解CuO,H2O和SO42-不能溶解CuO.
故答案为:(1)可能是H+使CuO溶解
(2)水不能溶解CuO
(3)Na2SO4
(4)稀H2SO4中的H+溶解CuO,H2O和SO42-不能溶解CuO
(5)CuO+H2SO4═CuSO4+H2O
(2)因为现象是氧化铜不溶解,所以结论是水分子不能使氧化铜溶解.
(3)因为Ⅰ实验证明了H2O不能使CuO溶解的结论,实验Ⅱ中既有H+,又有SO42-和H2O,其中水分子已经证明了不能使CuO溶解,而且知道实验Ⅱ中的现象是氧化铜溶解,但三个实验必须得出实验结果,所以实验Ⅲ中应加入的物质应该是含硫酸根的溶液,进而排除硫酸根是否能溶解氧化铜的结论.
(4)通过实验可以得知,水分子和硫酸根离子都不能使氧化铜溶解,使氧化铜溶解的是氢离子,只有含有大量氢离子的溶液才可以和氧化铜反应使之溶解,所以结论是:稀H2SO4中的H+熔解CuO,H2O和SO42-不能溶解CuO.
故答案为:(1)可能是H+使CuO溶解
(2)水不能溶解CuO
(3)Na2SO4
(4)稀H2SO4中的H+溶解CuO,H2O和SO42-不能溶解CuO
(5)CuO+H2SO4═CuSO4+H2O
点评:主要考查了酸溶液和氧化铜反应的本质,是溶液中的氢离子和氧化铜反应的结果,培养学生分析问题、解决问题的能力.

练习册系列答案
相关题目
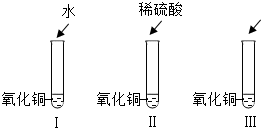
 28、氧化铜是一种黑色固体,可溶于稀硫酸.某同学想知道是稀硫酸中的哪种粒子(H+、SO42-、H2O)能使氧化铜溶解,请你帮他通过下图中的三个实验完成探究活动.
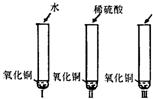
28、氧化铜是一种黑色固体,可溶于稀硫酸.某同学想知道是稀硫酸中的哪种粒子(H+、SO42-、H2O)能使氧化铜溶解,请你帮他通过下图中的三个实验完成探究活动. 21、氧化铜是一种黑色固体,可溶于稀硫酸:某同学想知道是稀硫酸中的哪种粒子(H2O、H+、SO42-)能使氧化铜溶解.请你和他一起通过下图I、II、III三个实验完成这次探究活动.
21、氧化铜是一种黑色固体,可溶于稀硫酸:某同学想知道是稀硫酸中的哪种粒子(H2O、H+、SO42-)能使氧化铜溶解.请你和他一起通过下图I、II、III三个实验完成这次探究活动.