��Ŀ����
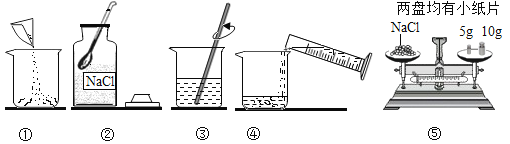
����Ŀ��ij��ȤС���ͬѧ�������������������ͭ��Һ��Ӧ����֤�����غ㶨������ʵ��� �ռ���һͰ����ɫ�ķ�Һ����������֪��Һ�к��� FeSO4��CuSO4����������л��ս���ͭ������ �������壬���������ʵ�鷽�������ʵ�鷽���ش��������⣺
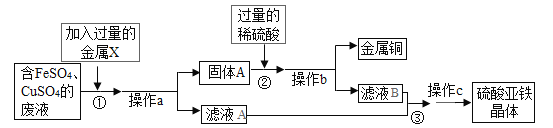
��1������ a ��������______���ò����в�������������_____��������з�����Ӧ�Ļ�ѧ����ʽΪ_____��
��2��������м������ϡ�����Ŀ����_____��
��3������Һ�л����������������õķ�����_____�������þ��壬�����������µ�ˮϴ�� 3�Ρ�ϴ���õ�ˮ���������ҵ��£���ԭ����_________��
���𰸡����� ���� Fe+CuSO4= Cu + FeSO4 �������� �����ᾧ ����ʱ�����������ܽ��С��ˮ���ܽ�������������٣�����������������ʧ
��������
��1������a �ǽ���������Һ���룬�ǹ��˲������ò����в�������������������������н���X��������������ͭ��Һ��Ӧ��������������Һ��ͭ����Ӧ�Ļ�ѧ����ʽΪ��Fe+CuSO4�TFeSO4+Cu��������ˣ�������Fe+CuSO4�TFeSO4+Cu��
��2��������й�����������ϡ���ᷴӦ��������������Һ���������������ϡ�����Ŀ���ǽ����������������������
��3������Һ�л����������������õķ����������ᾧ�������þ��壬�����������µ�ˮϴ ��3 �Ρ�ϴ���õ�ˮ���������ҵ��£���ԭ���ǵ���ʱ�����������ܽ��С���ܽ�����������٣��ܼ���������������ʧ����������ᾧ������ʱ�����������ܽ��С���ܽ�����������٣��ܼ���������������ʧ��

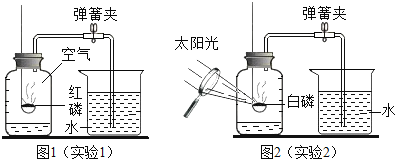
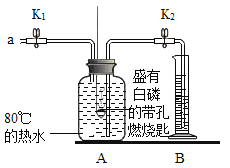
����Ŀ��ijͬѧҪ̽��ȼ�յ������������������ĺ���������������ʵ�顣
����֪:�����Ż��Ϊ40 ��C��
ʵ��װ�� | ʵ�鲽�輰���� |
| �����.���װ�õ������ԣ����������á� �����.��ʢ���������Ĵ���ȼ�ճ�����Aƿ�У����ײ�ȼ�ա� �����.��Aƿ�м���80 C��ˮ������ƿ�������ײ�ȼ�ա� �����.��K1��K2����a����Aƿ�й����������ƿ�е�Һ�����ȼ�ճײ�ʱ���ر�K1��K2����ʱ������ͲB��ˮ�����Ϊ200 mL���۲쵽Aƿ�еİ���ȼ�ա� |
��1��ͨ������___��֪��ȼ��ȼ�յ�����֮һ��Ҫ��������
��2����װ����ȴһ��ʱ���K2������۲쵽____��˵�����������������Լռ1/5������ʵ���ÿ������������������С��1/5��ԭ�������___��