题目内容
【题目】已知A、B、C、D四种元素核电荷数依次增大,A原子核内无中子,B的一种单质是自然界中最硬的物质,C是地壳中含量最多的元素,D的最外层电子数与C的最外层电子数相同,且C、D形成的化合物之一是形成酸雨的罪魁祸首,请回答下列问题:
(1)写出A、C形成两种液态化合物的化学式_________、__________。
(2)画出D的原子结构示意图_________。
(3)B、D两种元素按质量比3:16形成化合物的化学式__________。
【答案】H2O H2O2  CS2
CS2
【解析】
A原子核内无中子,则A是氢元素,B的一种单质是自然界中最硬的物质金刚石,则B是碳元素;C是地壳中含量最多的元素,则C是氧元素;D的最外层电子数与C的最外层电子数相同,则D是硫元素;且C、D形成的化合物之一是形成酸雨的罪魁祸首二氧化楼(SO2)。
(1)写出A氢元素、C氧元素形成两种液态化合物的化学式H2O和H2O2;
(2)画出D硫原子结构示意图: ;
;
(3)B碳元素、D硫元素,两种元素按质量比3:16形成化合物,设:碳原子个数为n硫原子个数为m,化学式可表示为:CnSm;12n:32m=3:16,n:m=1:2,则化学式为:CS2。

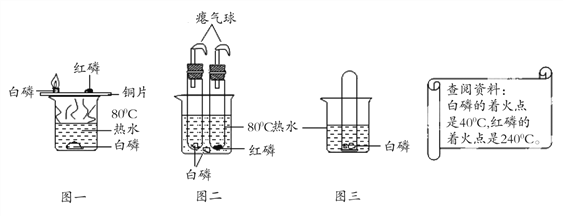
【题目】为了探究金属活动性,将锌和铜分别放入稀硫酸中,铜不反应而锌的表面有气泡产生,写出锌和稀硫酸反应的化学方程式:_____。
老师告诉学生,铜和浓硫酸在加热的条件下也能反应且产生气体。
(提出问题)铜与浓硫酸反应的生成物是什么?其中气体是什么?
(猜想假设)同学们对产生的气体作出了猜想。
猜想一:氢气;
猜想二:二氧化硫;
猜想三:氢气和二氧化硫的混合物。
(查阅资料)
(1)二氧化硫可以使品红溶液褪色,也能和碱性溶液反应
(2)H2+CuO![]() Cu+H2O
Cu+H2O
(实验探究)师生设计了如下装置进行实验(部分仪器省略),请完成下列表格。
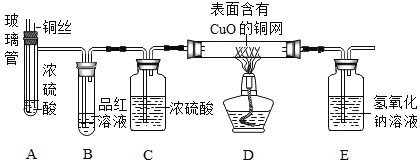
主要实验步骤 | 主要现象 | 解释或结论 |
①加热装置A一段时间 | 装置B中的现象_____ | 有二氧化硫生成 |
②点燃装置D处酒精灯 | 装置D玻璃管中无明显现象 | 猜想_____正确 |
③停止加热,将铜丝上提,向装置A中玻璃管鼓入空气 | / | / |
④冷却,将A中液体用水稀释 | A中液体变为_____色 | 有硫酸铜生成 |
(表达交流)
(1)在步骤③中,鼓入空气的目的是_____。
(2)请完成铜与浓硫酸反应的化学方程式:_____
(反思拓展)
(1)若将装置A中铜丝换成锌片,随着反应的进行,硫酸的浓度逐渐变小,装置D玻璃管中看到的现象是_____。
(2)下列各组药品能够证明锌的活动性比铜强的是_____(填序号)。
①锌、铜、稀盐酸 ②锌、硫酸铜溶液 ③锌、铜、氯化镁溶液