��Ŀ����
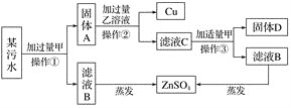
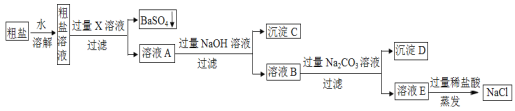
����Ŀ��ij��ҵ��ˮ���д���FeSO4������Ag+�����ࡣijͬѧ������������̻���Ag��FeSO47H2O���塣

��1��FeSO4��S�Ļ��ϼ�Ϊ_____��2����ԭ���û�ѧ���ű�ʾΪ_____��
��2���������У������˵õ��������Һ1��������Ҫ�IJ���������_____��_____�Ͳ���������������������_____��
��3���������У�������������_____���������û����ķ�����_____��
��4���������У�������������_____��������Ӧ�Ļ�ѧ����ʽ��_____��
��5��ijͬѧ��Ϊ���������������ù�����Ǵ�������������Ҫ���в�����������Ϊ�Ƿ������_____��������_____��
��6����Һ2����Һ3�ϲ���Ŀ����_____��_____��
���𰸡�+6 2Ag �ձ� ©�� ���� Fe H2SO4 ���� Fe+H2SO4��FeSO4+H2�� ������ ʹAg+��ȫ���û���������Ҫ������������� ���FeSO4������ ���ٷ�Һ�ŷ�
��������
��1����FeSO4�к���������������Ϊ��2�ۣ�����Ԫ��Ϊ��2�ۣ���S�Ļ��ϼ�Ϊx������x+����2����4����2��x��+6.2����ԭ���û�ѧ���ű�ʾΪ 2Ag��
��2��������Ҫ�IJ��������� �ձ���©���Ͳ��������������������� ������
��3����������Ҫ�Ƶ��������������Ϊ���������µ����ʣ��������У������������� Fe���������û�����ǹ����Һ����룬Ϊ���ˡ�
��4�����������������Ļ����õ�������������������Ϊ��ȥ�������Ҳ����������������ʣ����Լ���������� H2SO4��������Ӧ�Ļ�ѧ����ʽ�� Fe+H2SO4��FeSO4+H2����
��5��ʹAg+��ȫ���û���������Ҫ������������ۣ����Ծ��������������ù��岻�Ǵ���������
��6����Һ2����Һ3�ϲ���Ŀ���� ���FeSO4�����ʡ����ٷ�Һ�ŷš�
�ʴ�Ϊ��
��1��+6�� 2Ag����2���ձ��� ©������������3��Fe�� ���ˡ���4��H2SO4�� Fe+H2SO4��FeSO4+H2������5���������� ʹAg+��ȫ���û���������Ҫ������������ۡ���6�����FeSO4�����ʡ����ٷ�Һ�ŷš�