题目内容
【题目】根据下图所示装置回答下列有关问题
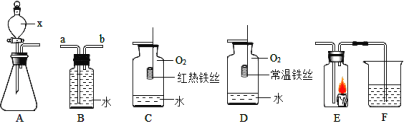
(1)请写出标号为x的仪器的名称____________________
(2)若装置B用排水法收集氧气,进气口应为__________端(选填“a”或“b”)
(3)用装置B除去CO2中HCl气体应加入的试剂是________________,其化学方程式为_______
(4)对比装置C和D,可以得出可燃物燃烧的条件是_______
(5)某同学连接A、E、F进行实验,A中所加药品不同,F中所加药品相同。
①若实验时E中蜡烛熄灭,F中溶液变浑浊,则E中现象说明A中产生的气体所具有的性质是_______
②若实验时E中蜡烛燃烧更旺,F中溶液变浑浊,则A中反应的化学方程式是______
(6)取12g石灰石(主要成分是CaCO3,杂质不参加反应)放入烧杯中,向其中加入100g一定质量分数的稀盐酸,二者恰好完全反应。反应结束后,称量烧杯中剩余物质的总质量为107.6g(不包括烧杯的质量,且气体溶解忽略不计)。则稀盐酸中溶质的质量分数是多少_______?
【答案】分液漏斗 b 饱和碳酸氢钠溶液 NaHCO3+HCl=NaCl+CO2↑+H2O 温度达到着火点 不支持燃烧也不燃烧 2H2O2![]() 2H2O+O2 7.3%
2H2O+O2 7.3%
【解析】
(1)熟记仪器的名称;
(2)根据氧气的密度比水小来分析;
(3)根据除杂原则来分析;
(4)根据实验中的对比来分析;
(5)若实验时E中蜡烛熄灭,F中溶液变浑浊,则E中现象说明A中产生的气体是二氧化碳,它所具有的性质是:不支持燃烧也不燃烧;若实验时E中蜡烛燃烧更旺,F中溶液变浑浊,则A中反应生成的是氧气,过氧化氢在二氧化锰做催化剂的条件下生成水和氧气,要注意配平。
(6)根据碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳;根据质量守恒定律,烧杯内质量的减少的质量即生成的二氧化碳气体的质量,据此根据反应的化学方程式列式计算出参加反应的碳酸钙的质量、稀盐酸中溶质的质量,进而计算出稀盐酸中溶质的质量分数。
(1)仪器x是分液漏斗;故填:分液漏斗;
(2)氧气的密度比水小,所以用装置B来收集氧气时,氧气从短管进入;故填:b;
(3)用装置B除去CO2中HCl气体应加入的试剂是:饱和碳酸氢钠溶液;碳酸氢钠和盐酸反应生成氯化钠和二氧化碳和水;故答案为:饱和碳酸氢钠溶液;NaHCO3+HCl=NaCl+CO2↑+H2O;
(4)C中红热的铁丝在氧气中能够剧烈燃烧,而D中常温的铁丝在氧气中不燃烧,对比可知燃烧的条件之一是温度要达到可燃物的着火点;故答案为:温度达到着火点;
(5)①若实验时E中蜡烛熄灭,F中溶液变浑浊,则E中现象说明A中产生的气体是二氧化碳,它所具有的性质是:不支持燃烧也不燃烧;
②若实验时E中蜡烛燃烧更旺,F中溶液变浑浊,则A中反应生成的是氧气,过氧化氢在二氧化锰做催化剂的条件下生成水和氧气,要注意配平;故答案为:①不支持燃烧也不燃烧;②2H2O2![]() 2H2O+O2↑。
2H2O+O2↑。
(6)由质量守恒定律可知,反应生成二氧化碳的质量为12g+100g-107.6g=4.4g。
设参加反应的盐酸的质量为x,

![]()
x=7.3g
稀盐酸中溶质的质量分数是
![]()
答:稀盐酸中溶质的质量分数是7.3%.

【题目】下列是电解水反应示意图和装置。示意图①~③中,“●”表示氢原子,“O”表示氧原子。
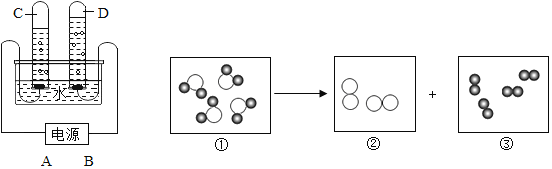
(1)图中表示化合物的是_____,表示单质的是_____(用序号填空)。
(2)②所代表的物质是左图中试管(填字母)_____中产生的气体,图中A是电源的_____(填“正”或“负”)极。
(3)为了探究C和D玻璃管分别产生的是什么气体,用燃着的木条分别在两个玻璃管口检验电解反应中产生的气体,观察并记录发生的现象,请填写下表:
C玻璃管 | D玻璃管 | |
现象 | _____ | _____ |
解释 | _____ | _____ |
(4)写出图中反应的化学符号表达式:_____。