题目内容
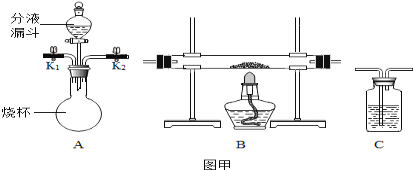
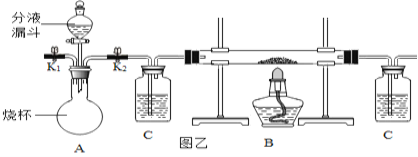
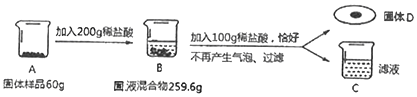
【题目】某化学兴趣小组在探究物质的性质实验活动中进行了如图所示的实验。
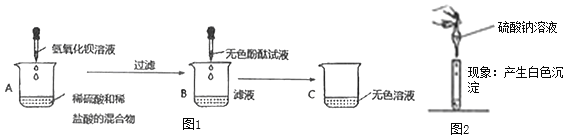
A烧杯中一定发生的化学反应方程式为______;B烧杯中滤液一定不含的离子是______,小组同学对C烧杯中溶液的成分产生了兴趣,进行了下面探究。
(提出问题)c烧杯溶液的溶质中含有什么离子?(不考虑酚酞)
(猜想与假设)
甲猜想:H+、SO42-和Cl-
乙猜想:H+和Cl-
丙猜想:H+、SO42-、Cl-和Ba2+
丁猜想:Ba2+和Cl-
(表达与交流)丁同学认为上述______的猜想一定不正确,丁同学认为自己的猜想是正确的。
(活动与探究)丁同学为了证明自己的猜想,用试管取少量C中溶液,做如图实验,根据观察到的现象得出自己猜想成立的结论。请你对他的结论做出评价______。
甲同学继续了丁同学的实验,他继续向试管中加入一种试剂,观察到了明显的实验的现象。
得出结论:丁同学猜想不正确,甲同学加入的试剂可能是______,通过以上实验探究你认为溶液中含有的离子为______。
(总结与反思)通过上述探究过程可知,在分析和探究反应后溶液中离子成分时,首先可根据______来推断出:不参与反应的离子一定存在,然后加入适当的试剂______是否存在,才能得出正确结论。
【答案】Ba(OH)2+H2SO4=BaSO4↓+2H2O,Ba(OH)2+2HCl=BaCl2+2H2O 氢氧根离子 丙 不正确,加入硫酸钠溶液产生白色沉淀只能证明溶液中含有Ba2+,无法证明溶液中是否有H+,若溶液中含有Ba2+、H+和Cl-,加入硫酸钠溶液也能产生白色沉淀 石蕊试液 H+、Cl-、Ba2+ 离子的化学性质 根据产生的明显且唯一的实验现象验证可能存在的离子
【解析】
A烧杯中一定发生的反应:氢氧化钡和稀硫酸反应生成硫酸钡沉淀和水,和稀盐酸反应生成氯化钡和水,化学反应方程式为:Ba(OH)2+H2SO4═BaSO4↓+2H2O,Ba(OH)2+2HCl═BaCl2+2H2O;
B烧杯中滤液加入酚酞试液不变红色,说明滤液中一定不含的离子是氢氧根离子。
故填:Ba(OH)2+H2SO4═BaSO4↓+2H2O,Ba(OH)2+2HCl═BaCl2+2H2O;氢氧根离子。
[表达与交流]
丁同学认为上述丙的猜想一定不正确,这是因为钡离子和硫酸根离子不能共存。
故填:丙。
[活动与探究]
丁同学的结论不正确,加入硫酸钠溶液产生白色沉淀只能证明溶液中含有Ba2+,无法证明溶液中是否有H+,若溶液中含有Ba2+、H+和Cl-,加入硫酸钠溶液也能产生白色沉淀;
丁同学猜想不正确,甲同学加入的试剂可能是石蕊试液,加入石蕊试液后溶液变红色,说明溶液中含有氢离子,通过以上实验探究可知,溶液中含有的离子为H+、Cl-、Ba2+。
故填:不正确,加入硫酸钠溶液产生白色沉淀只能证明溶液中含有Ba2+,无法证明溶液中是否有H+,若溶液中含有Ba2+、H+和Cl-,加入硫酸钠溶液也能产生白色沉淀;石蕊试液;H+、Cl-、Ba2+。
[总结与反思]
通过上述探究过程可知,在分析和探究反应后溶液中离子成分时,首先可根据离子的化学性质来推断出:不参与反应的离子一定存在,然后加入适当的试剂,根据产生的明显且唯一的实验现象验证可能存在的离子是否存在,才能得出正确结论。

 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案