题目内容
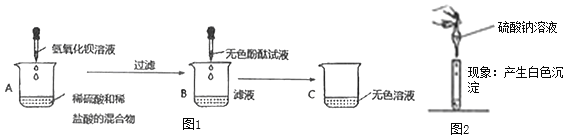
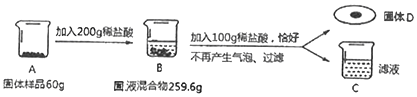
【题目】化学实验小组要测定某黄铜(成分:铜、锌)样品中各成分含量,老师为他们提供了足量的一定溶质质量分数的稀盐酸以及必要的实验仪器,小组同学所做实验数据记录如图:
(1)上述过程中发生反应的化学方程式为______。
(2)根据已知条件列出求解A烧杯中参加反应固体的质量(X)的比例式______。
(3)配制上述实验过程中所使用的稀盐酸,需用溶质质量分数为36.5%的浓盐酸质量为______。
(4)样品中铜的质量分数为______。
(5)若向C烧杯中加入81.1g水,所得不饱和溶液中溶质质量分数为______。
(6)若想生产200t上述黄铜,理论上需用含Cu2S 27%的辉铜矿(杂质中不含铜元素)______t。
【答案】Zn+2HCl=ZnCl2+H2↑ ![]() =
=![]() 60g 67.5% 10.2% 625
60g 67.5% 10.2% 625
【解析】
上述过程中只有黄铜中的锌和盐酸反应生成氯化锌和氢气,对应的化学方程式为Zn+2HCl=ZnCl2+H2↑。
根据质量守恒定律可得,A烧杯中生成的氢气的质量为60g+200g-259.6g=0.4g,由于继续加入100g盐酸锌才完全反应。
设参加反应固体锌的质量为x,生成的氯化锌的质量为y,消耗的盐酸的质量分数为z
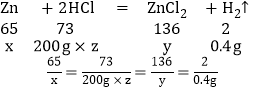
x=13g
y=27.2g
z=7.3%
配制上述实验过程中所使用的稀盐酸,需用溶质质量分数为36.5%的浓盐酸质量为![]() =60g。
=60g。
样品中铜的质量分数为1-![]() ×100%=67.5%。
×100%=67.5%。
(5)若向C烧杯中加入81.1g水,所得不饱和溶液中溶质质量分数为![]() ×100%=10.2%。
×100%=10.2%。
(6)若想生产200t上述黄铜,理论上需用含Cu2S 27%的辉铜矿(杂质中不含铜元素)200t×67.5%![]() ÷27%=625t。
÷27%=625t。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
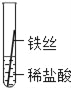
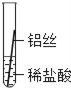
小学生10分钟应用题系列答案【题目】铁、铝、铜是常见的三种金属。生活中的铝制品和铜器表面一般不用防锈,而铁制品则需防锈处理。
(提出问题)这三种金属的活动性强弱到底如何呢?
(实验探究)同学们将粗细相同的铁丝、铝丝、铜丝分别插入等体积、等浓度的稀盐酸溶液中:
操作 |
|
|
|
片刻后现象 | 缓慢产生少量气泡 | 无气泡 | 无气泡 |
几分钟后现象 | 缓慢产生少量气泡 | 快速产生大量气泡 | 无气泡 |
(讨论交流)
分析上述现象,得出三种金属的活动性由强到弱的顺序是_____。
铝丝插入稀盐酸的实验中,请你分析随着时间变化而出现的现象,并猜测该过程中还发生了什么反应?_____。(用文字叙述)
(反思改进)氧化铝与稀盐酸反应
做验证金属的性质实验前,需对金属进行怎样的处理?_____。
有同学提出“只用一支盛有少量稀盐酸的试管,只需调整金属丝的插入顺序,也能证明三种金属的活动性顺序”。则金属丝的插入顺序可以为_____(填一种顺序即可)。
(拓展迁移)将一定质量的铝粉放入含有硫酸亚铁、硫酸铜的混合溶液中,充分反应后,过滤。向滤出的固体中滴加稀硫酸,发现有气泡产生。
滤液中一定含有的溶质是_____(填化学式)。
该过程中产生气体时,一定发生的反应的方程式为_____。
【题目】常见的盐的组成填表:
名称 | 化学式 | 阴离子 | 阳离子 |
氯化钠 | _____ | _____ | _____ |
碳酸钠 | _____ | _____ | _____ |
碳酸氢钠 | _____ | _____ | _____ |
碳酸钙 | _____ | _____ | _____ |
硫酸铜 | _____ | _____ | _____ |