题目内容
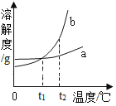
【题目】如图是甲、乙、丙三种物质的溶解度曲线.
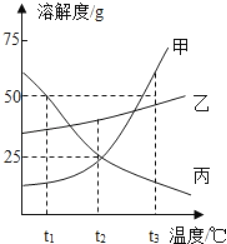
(1)t2℃时,甲的溶解度为_____;
(2)t3℃时,甲、乙各50g,分别加入到100g水中,充分搅拌.其中,不能形成饱和溶液的是_____;
(3)t3℃时,甲的饱和溶液中含有少量的丙,现要提纯甲,可以采用的方法是_____;
(4)下列说法正确的是_____.
A 将甲、乙的饱和溶液分别从t1℃升温到t2℃,溶质质量分数都不变
B t2℃时,向100g20%甲的饱和溶液中加入100g水,充分搅拌,溶液质量分数为10%
C t3℃时,等质量的甲、乙、丙分别制成饱和溶液,需要水的质量最多的是甲
D 升高丙的温度,一定有晶体析出.
【答案】25g或25g/100g水 甲 降温结晶 AB
【解析】
(1)t2℃时,甲的溶解度为25g或25g/100g水;
(2)t3℃时,甲的溶解度大于50g,乙的溶解度小于50g,所以,甲、乙各50g,分别加入到100g水中,充分搅拌.其中,不能形成饱和溶液的是甲;
(3)甲的溶解度随温度的升高而增大,且变化较大,丙的溶解度随温度的升高而减小,所以t3℃时,甲的饱和溶液中含有少量的丙,要提纯甲,可以采用降温结晶的方法得到甲的晶体;
(4)A、甲、乙的溶解度均随温度的升高而增大,将甲、乙的饱和溶液分别从t1℃升温到t2℃,由饱和溶液变为不饱和溶液,溶质、溶剂的质量不变,所以溶质质量分数都不变,正确;
B、t2℃时,向100g20%甲的饱和溶液中加入100g水,充分搅拌,溶液质量分数为![]() ×100%=10%,正确;
×100%=10%,正确;
C、t3℃时,三种物质的溶解度大小关系是:甲>乙>丙,因此等质量的甲、乙、丙分别制成饱和溶液,溶解需要水的质量最多的是丙,故错误;
D、若丙为不饱和溶液,升高丙的温度依然不饱和,则无晶体析出,故错误;

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案