题目内容
【题目】一定条件下,在一个密闭容器内发生某反应,测得反应前后各物质的质量如图所示,下列说法正确的是( )
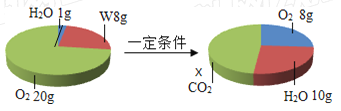
A. X的值为22 B. 该反应属于置换反应
C. W由碳、氢两种元素组成 D. W中碳、氢元素原子个数比为1:4
【答案】D
【解析】根据质量守恒定律:参加化学反应的各物质质量总和等于反应后生成的各物质质量总和,利用在发生化学反应时反应物质量会减小,生成物质量会增多,判断反应物与生成物,进而书写出反应的表达式,判断反应的类型据此回答问题即可。
解:由于三种物质中W和氧气质量减小,氧气的质量减小了20g-8g=12g,所以W和氧气是反应物,反应物的总质量为8g+12g=20g。而水的质量增加,且增加值是10g﹣1g=9g,所以水是生成物。依据质量守恒定律参加化学反应的各物质质量总和等于反应后生成的各物质质量总和,所以二氧化碳必是生成物且生成的质量是20g﹣9g=11g;此反应的表达式可表示为W+O2![]() CO2+H2O。
CO2+H2O。
A、由以上分析知X的值为11,故错误;
B、由于该反应的表达式是W+O2![]() CO2+H2O,生成物是两种化合物,不属于置换反应,故错误;
CO2+H2O,生成物是两种化合物,不属于置换反应,故错误;
C、根据质量守恒定律,由反应表达式可以看出W中一定含有碳氢两种元素,是否含有氧元素则要通过生成物中的氧元素与反应的氧气质量进行比较,生成的水中氧元素的质量为:9g×![]() =8g,二氧化碳中氧元素的质量:11g×
=8g,二氧化碳中氧元素的质量:11g×![]() =8g,两者的质量和为16g,而参加反应的氧气的质量为12g,所以可判断W中含有氧元素,故错误;
=8g,两者的质量和为16g,而参加反应的氧气的质量为12g,所以可判断W中含有氧元素,故错误;
D、由C的分析可知W中碳元素质量为(11g﹣8g)=3g,氢元素的质量为(9g﹣8g)=1g,因此W中碳、氢元素原子个数比为![]() =1:4,故正确。
=1:4,故正确。
故选D。

【题目】如表所示是相应各物质反应前后的质量关系,完成相应各题.
物质 | O2 | CO2 | H2O | M |
反应前质量/g | 100 | 1 | 1 | 46 |
反应后质量/g | 4 | 89 | 55 | X |
则:
(1)表中X的值为
(2)物质M中一定有的元素为(填元素符号)
(3)若M的相对分子质量为46,请写出M在氧气中燃烧的化学方程式: .
