题目内容
【题目】有等质量的镁和锌,前者放入质量分数为10%的稀盐酸中,后者放入质量分数为10%的稀硫酸中,产生氢气的质量随时间变化曲线如图所示。下列说法正确的是( )
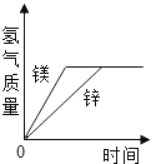
A. 锌一定没有剩余
B. 消耗的稀盐酸和稀硫酸质量之比为73:98
C. 最终产生氢气的质量相等
D. 消耗镁的质量与消耗锌的质量之比为1:1
【答案】BC
【解析】
A、等质量的不同金属得到的氢气一样多,说明参与反应的金属的质量一定不一样多,因此至少有一种金属剩余,由M~H2可知,相对原子质量小的金属有剩余,则镁有剩余,而锌没有剩余。故A错误;
B、由于得到的氢气一样多,根据元素的质量守恒可知,参加反应的稀盐酸和稀硫酸的溶质中氢元素的质量一定相等,则2HCl~2H~H2SO4,稀盐酸和稀硫酸质量之比为36.5×2:98=73:98,故B正确;
C、根据图象可以得到,最终产生的氢气的质量相等,故C正确;
D、由于锌的相对原子质量大,因此得到相同质量的氢气,参加反应的金属锌的质量要大一些,则消耗的镁与锌的质量
之比不等于1:1,故D错误;
故选:BC。

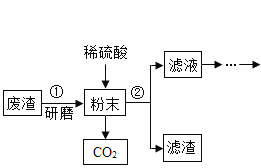
【题目】我国古代纺织业常将草木灰(主要成分K2CO3)和生石灰在水中混合,用上层清液漂白织物。
(资料)①K2CO3 + Ca(OH)2 = CaCO3↓ + 2KOH
②Ca(OH)2、K2CO3 和 KOH 的部分溶解度如下表:
温度/℃ | 0 | 10 | 20 | 30 | 50 | |
溶解度/g | Ca(OH)2 | 0.18 | 0.17 | 0.16 | 0.15 | 0.14 |
K2CO3 | 107 | 109 | 110 | 114 | 121 | |
KOH | 97 | 103 | 112 | 126 | 140 | |
(1)20℃时,100 g 水中最多可溶解 K2CO3 的质量是__________g,溶质的质量分数为 50% 的 KOH 溶液属于 ___________溶液(填“饱和”或“不饱和”)。
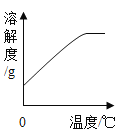
(2)某温度时,向一定量的饱和氢氧化钙溶液中加入少量生石灰,恢复到原温度,某些量随时间变化的关系如图所示。则纵坐标可能表示的是____________(填序号)
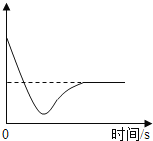
a溶质的质量 b溶质的质量分数 c 氢氧化钙的溶解度 d溶剂的质量 e溶液的质量
(3)20℃时,将 1.38 g K2CO3 固体放入 100 g 水中,并加入一定量的氢氧化钙,搅拌使其充分反应,恢复到原温度,过滤,得到质量为 1.5 g 的固体。所得滤液中的溶质是____________,加入氢氧化钙的质量是_________g。
(4)将纯净的氯化钠配制成溶液。20℃时,向 4 个盛有 200 g 水的烧杯中,分别加入一定质量的氯化钠并充分溶解。4 组实验数据如下:
实验序号 | ① | ② | ③ | ④ |
加入氯化钠的质量/g | 9 | 36 | 81 | 90 |
溶液质量/g | 209 | 236 | 272 | 272 |
若将②中得到的溶液稀释成质量分数为 0.9%的生理盐水,需加水的质量是________g。关于上述实验的叙述正确的是__________(填序号)。
a①②所得溶液是不饱和溶液
b③④所得溶液中,溶质的质量分数相等
c20℃时,200 g 水中最多溶解氯化钠的质量为 72 g
d20℃时,将④继续恒温蒸发 100 g 水,过滤,得到质量为 36 g 的固体