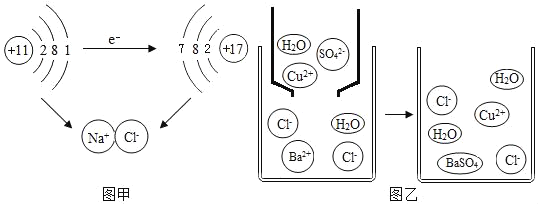
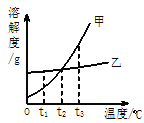
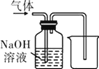
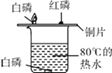
题目内容
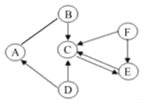
【题目】概念之间存在并列、交叉和包含等3种关系。符合如图所示关系的一组概念是( )
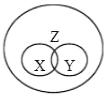
X | Y | Z | |
A | 酸 | 碱 | 化合物 |
B | 氧化物 | 化合物 | 纯净物 |
C | 硝酸盐 | 铵盐 | 盐 |
D | 合成材料 | 合金 | 有机物 |
A. AB. BC. CD. D
【答案】C
【解析】
酸是电离时生成的阳离子全部是氢离子的化合物,碱是电离出的阴离子全部是氢氧根离子的化合物,化合物是由不同种元素组成的纯净物,氧化物是由两种元素组成,其中一种元素为氧元素的化合物,合金是由金属和金属或金属和非金属熔合而成的具有金属特性的物质,纯净物是由同种物质组成的物质。
A、酸和碱是两类物质,不能交叉,故A不正确;
B、氧化物属于化合物,化合物属于纯净物,它们是包含关系,不能交叉,故B不正确;
C、硝酸盐和铵盐都属于盐,硝酸盐和铵盐都含有氮元素,故C正确;
D、材料分为合成材料、金属材料、无机非金属材料、复合材料,物质分为有机物和无机物,合成材料和合金不能交叉,故D不正确。故C正确。

 阅读快车系列答案
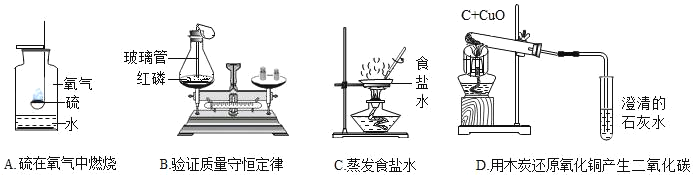
阅读快车系列答案【题目】下列实验设计不能达到实验目的的是( )
选项 | A | B | C | D |
实验目的 | 除去CO中的CO2,并回收CO | 探究可燃物燃烧所需的条件 | 除去氧化铜粉末中的铜粉 | 鉴别NH4NO3、CuSO4和NaCl三种白色粉末 |
实验设计 |
|
|
|
|
A. AB. BC. CD. D
【题目】白云石粉是一种生产高级玻璃器皿、医药用瓶、光学玻璃的原料,某化学兴趣小组对白云石粉极其好奇,决定对其进行探究。
(查阅资料)白云石属于碳酸盐矿物,白云石粉主要成分的化学式可表示为:xMgCO3 ·yCaCO3。(杂质是二氧化硅,其不溶于水,也不与盐酸反应,受热不分解)
一、定性探究:白云石粉的成分和性质
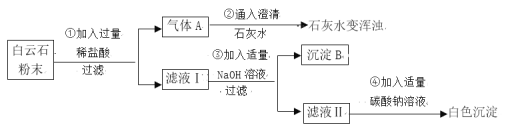
(实验分析)
(1)由步骤①②的现象可得出白云石粉中一定含有的离子是____________(填离子符号)。
(2)步骤③生成氢氧化镁的化学方程式是________________________________。该反应属于______(填写化学反应基本类型)。
(3)滤液Ⅱ中的溶质是_________________________。
(结 论)综合上述实验现象可初步证明白云石由碳酸钙、碳酸镁组成。
(实验质疑)小组同学经过讨论认为:因氢氧化钙微溶于水,导致沉淀B中除了氢氧化镁之外应该还混有氢氧化钙,对定量测定白云石粉的组成干扰较大,在老师的指导下该兴趣小组采用热分解法进行定量探究。
二、定量探究:白云石的组成
(查阅资料)碳酸钙开始分解的温度为898℃,1000℃时完全分解生成生石灰和二氧化碳气体;碳酸镁与碳酸钙的化学性质相似;碳酸镁开始分解的温度为540℃,700℃时完全分解。
(实验设计)为测定白云石中的含钙量及x:y的值,该兴趣小组设计了如下装置并进行实验:
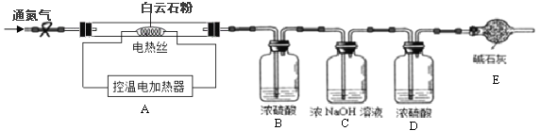
(实验步骤)①组装仪器,检查装置的气密性;②准确称取15.0g 白云石粉末放在A装置中,打开弹簧夹,鼓入一段时间氮气,称量B、C、D装置的质量;③关闭弹簧夹,打开控温电加热器,缓缓调升温度至700℃,持续加热至固体质量不变;④打开弹簧夹,缓缓鼓入一段时间氮气,准确称量B、C、D装置的质量;⑤关闭弹簧夹,调升温度至1000℃,持续加热至固体质量不变,打开弹簧夹,缓缓鼓入一段时间氮气,准确称量B、C、D装置的质量。
实验数据记录如下表:
B中溶液质量/g | C中溶液质量/g | D中溶液质量/g | |
反应前 | 50.0 | 100.0 | 50.0 |
700℃ | 50.0 | 102.1 | 50.1 |
1000℃ | 50.0 | 106.3 | 50.3 |
(实验分析和数据处理)
(4)装置D的作用是______________;
(5)持续加热至固体质量不变后缓缓鼓入一段时间氮气的目的是_______________。
(6)计算白云石中碳酸镁的质量分数。(写出计算过程):_______________。
(7)设计实验证明白云石粉已完全分解的实验方法是_____________________________(写出实验方法、现象)
(8)白云石(xMgCO3 ·yCaCO3)中的 x:y=___________(最简整数比),若加热前没有鼓入一段时间的氮气,将会导致x:y的值________(填偏大、偏小或不变)。