题目内容
【题目】CuCl2是一种重要的化工原料,工业上常在FeCl3催化作用下,向Cu与稀盐酸的混合物中持续通入空气的条件下制得,反应原理如图所示。下列说法错误的是
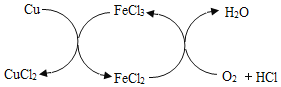
A. 反应过程中不需要持续添加FeCl3溶液
B. 该实验说明Cu能与稀盐酸发生置换反应
C. 缓缓通入空气,能提高铜的利用率
D. 制备CuCl2的总反应为2Cu+O2+4HCl![]() 2uCl2+2H2O
2uCl2+2H2O
【答案】B
【解析】
开始反应为4FeCl2+O2+4HCl═4FeCl3+2H2O,后来反应为Cu+2FeCl3=2FeCl2+CuCl2。
所以总反应相当于为:O2+4HCl+2Cu=2H2O+2CuCl2。
A、由于反应过程中氯化铁是第一个反应的生成物,是第二个反应的反应物,所以不需要添加FeCl3溶液,故A正确;
B、整个过程可以看出是铜被氯化铁氧化,所以不能说是铜和盐酸发生置换反应,故B错误;
C、空气是廉价的资源,缓缓通入空气能提高Cu和稀盐酸的利用率,故C正确;
D、根据分析可知,制备CuCl2的总反应为:2Cu+O2+4HCl![]() 2uCl2+2H2O,故D正确。
2uCl2+2H2O,故D正确。
故选:B。

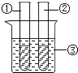
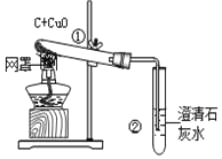
【题目】某同学设计下表所示实验,探究金属铜对H2O2分解速率的影响.
操 作 | 装 置 | 现 象 |
(1).取一个铜丝网,卷成筒形,固定在铁丝上. |
| |
(2).分别向①和②中注入15mL、30%的H2O2溶液,并放入盛有热水的③中. |
| 约1min后可观察到①和②中都有少量气泡产生. |
(3).把铜丝网插入①中. |
| ①中有大量气泡产生,5min后不再有气泡产生;此时②中仍然不断有少量气泡产生. |
回答下列问题:
(1)仪器①的名称是_____;仪器③的名称是_____.
(2)仪器②中实验的目的是_____.
(3)能否可以得出铜可以加快H2O2分解的速率_____(填“是”或“否”),理由是_____
(4)如果用上述实验探究铜是不是H2O2分解的催化剂,需要对上述实验方案进行补充,其中必要的是_____.
A 称量实验前铜丝网的质量和实验后干燥铜丝网的质量
B 向仪器②中加入二氧化锰
C 将实验后的铜丝网插入AgNO3溶液中
D 将铁丝换成铜丝
E 将过氧化氢溶液加水稀释.
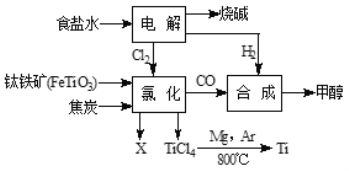
【题目】工业上用闪锌矿(主要成分是ZnS,含有PbS等杂质)制备锌的流程如图(部分产物略去)
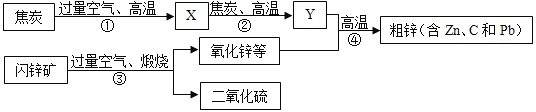
(1)焙烧时,产生的“气体M”为一种质量比为1:1的氧化物,其化学式为_____;
(2)流程中用过量空气的目的是_____;
(3)写出反应④中有ZnO参与的化学反应方程式_____;
(4)焦炭在上述流程中起着举足轻重的作用,下列属于焦炭作用的是_____;
a.作为燃料,为制备锌的化学反应提供能量
b.作为还原剂与二氧化碳反应
c.除去矿石中的杂质
物质 | Zn | Pb | C |
沸点℃ | 907 | 1749 | 4827 |
(5)根据上表数据:从粗锌中分离出纯锌的合适温度(t)的范围为_____。