题目内容
【题目】某课外活动小组进行如下实验探究。
(1)验证物质的燃烧条件
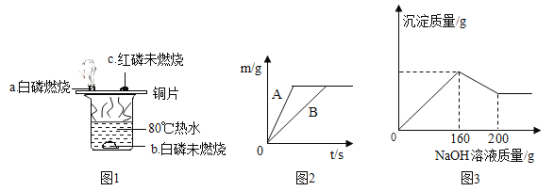
根据图1进行实验,实验现象如图所示.80℃热水的作用是_____。
(2)①将一定质量的锌粒投入含有 Cu(NO3)2 和 Fe(NO3)2 的混合溶液中,充分反应后过滤,若滤液中只含一种溶质,则滤渣中一定含有_____。(填化学用语)
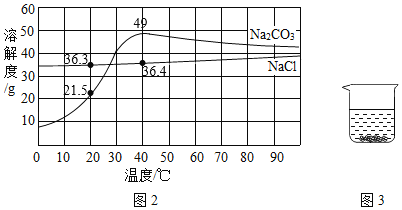
②在质量相等、溶质质量分数相同的稀硫酸中,分别加入等质量的锌粉和铁粉,生成氢气质量(m)随反应时间(t)的变化曲线如图 2 所示。下列表述不正确的是_____(填序号)。
a表示锌和稀硫酸的反应曲线 b反应结束后消耗两种金属的质量相等
c反应结束后两种金属一定都有剩余 d反应结束后稀硫酸都没有剩余
e反应结束后生成的氢气质量相等。
(3)已知氢氧化铝能溶解在过量的氢氧化钠溶液中生成偏铝酸钠(NaAlO2)溶液,有关化学方程式为:Al(OH)3+NaOH=NaAlO2+2H2O.现有某无色溶液,可能含有盐酸、硫酸镁、硝酸钾、硫酸铜、氯化铝、碳酸钠中的一种或数种。取一定量该溶液于烧杯中,往其中逐滴加入 NaOH 溶液,产生沉淀的质量与加入NaOH溶液的质量关系如图3所示。推断在该溶液中一定存在的物质是_____,一定不存在的物质是_____,可能存在的物质是_____。
【答案】隔绝氧气,提供热量 Cu、Fe bc 氯化铝、硫酸镁 盐酸、硫酸铜、碳酸钠 硝酸钾
【解析】
(1)80℃热水的作用是一是提供热量,给水中的及铜片上的可燃物加热,二是给水中的白磷隔绝氧气或者空气,以便和空气中的白磷进行对比;
(2)①由于金属的活动性是:锌>铁>铜,将一定质量的锌粒投入含有Cu(NO3)2和Fe(NO3)2的混合溶液中,锌先与硝酸铜反应生成了铜和硝酸锌,当硝酸铜完全反应后再与硝酸亚铁反应生成了硝酸锌和铁,充分反应后过滤,若滤液中只含一种溶质,该溶质就是硝酸锌,说明了溶液中的铜和铁完全被置换出来了,则滤渣中一定含有:Cu、Fe;
②a、由于锌的活动性大于铁,反应的时间短,所以A表示锌和稀硫酸的反应曲线,故正确;
b、由图象可知,生成的氢气相同,则反应的酸相同,则反应结束后消耗两种金属的质量不相等,故错误;
c、反应结束后可能一种金属剩余或两种金属都有剩余,故错误;
d、由图象可知,反应结束后稀硫酸都没有剩余,故正确;
d、由图象可知,反应结束后生成的氢气质量相等,故正确。
故选:bc;
(3)该溶液为无色,说明一定不含硫酸铜;观察图象,当加入160g氢氧化钠溶液时沉淀质量达到最大,后来逐渐减小,根据题意:氢氧化铝和氢氧化钠可发生反应,说明该溶液中一定含有氯化铝;先生成氢氧化铝,后来氢氧化铝与氢氧化钠发生反应使沉淀减少,沉淀并未全部反应完,说明还含有其他沉淀;而沉淀从原点开始,说明溶液中一定不含盐酸,因为盐酸可与生成的氢氧化铝发生反应;剩余物质中,硫酸镁可与氢氧化钠反应生成氢氧化镁沉淀,碳酸钠、硝酸钾不与氢氧化钠反应,故一定含有硫酸镁,碳酸钠和硫酸镁会结合生成微溶性的碳酸镁,故二者不能共存,所以溶液中一定不含碳酸钠,可能含有硝酸钾。
故答案为:(1)隔绝氧气,提供热量;
(2)①Cu、Fe;
②bc;
(3)氯化铝、硫酸镁,盐酸、硫酸铜、碳酸钠,硝酸钾。

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案【题目】小明对妈妈杀鱼时从鱼肚内取出的鳔产生了兴趣,他确定了“探究鳔内气体体积和成分”作为研究性学习的课题.小明通过查阅有关资料获知:这种鱼鳔内氧气约占1/4,其余主要是二氧化碳和氮气.探究分两步进行.
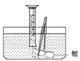
(1)测量鳔内气体体积.小明设计了两种方法:,你认为两合理的是________ (选序号);
A.用医用注射器抽取鳔内气体,测量其体积;
B.在水下剌破鳔,用排水集气法收集鳔内气体并测量其体积(如图).
(2)探究鳔内气体的成分.给你两集气瓶的鳔内气体,请你帮助他设计实验验证假设.
方法 | 现象 | |
验证鳔内含O2 | ________ | ________ |
验证鳔内含CO2 | ________ | ________ |
(3)关于空气的组成,你还能从下列实验中得出什么结论?
①小白鼠放在有空气的密闭容器中可以存活一段时间,说明________.
②夏天,从冰箱里取出的饮料瓶放在空气里,过一会儿瓶子外壁有一层水珠,说明________.
③空气是制造氮肥的原料,说明________.