题目内容
【题目】KNO3、NaNO3、NaCl三种物质的溶解度曲线如下图所示,下列说法正确的是( )
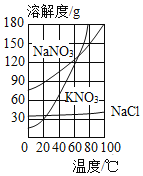
A.KNO3的溶解度比NaCl大
B.将KNO3饱和溶液降温,溶液中KNO3的质量分数不变
C.KNO3饱和溶液中含少量NaCl,可通过降温结晶的方法提纯
D.100g40℃NaNO3的饱和溶液降温至0℃,析出NaNO3固体31g
【答案】C
【解析】
A、由于没有指明温度,无法比较溶解度大小,故选项错误;
B、KNO3溶解度会随着温度的降低而减小,将KNO3饱和溶液降温,会有晶体析出,溶液中KNO3的质量分数变小,故选项错误;
C、KNO3溶解度会随着温度的降低而减小,氯化钠的溶解度受温度变化影响较小,所以KNO3饱和溶液中含少量NaCl,可通过降温结晶的方法提纯,故选项正确;
D、溶解度是指一定温度下,100g溶剂的里最多溶解的溶质质量;40℃的NaNO3饱和溶液降温至0℃,溶解度的变化为104g-73g=31g,即含有100g溶剂水的NaNO3饱和溶液由40℃的降温至0℃,最多析出31g硝酸钠,100gNaNO3的饱和溶液析出的质量必小于31g,故选项错误。故选C。

【题目】硼泥主要由MgO 和SiO2 组成,含有少量Fe2O3 、FeO 、Al2O3 等杂质。用硼泥生产氢氧化镁的工艺流程如图所示:
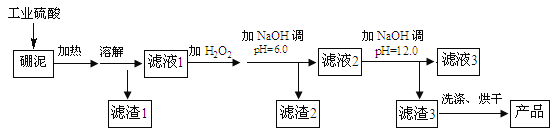
提示信息:
Ⅰ.加入H2O2的目的是将溶液中 Fe2+氧化为 Fe3+
Ⅱ.SiO2不与硫酸反应
Ⅲ.已知某些金属阳离子在溶液中生成氢氧化物沉淀的pH如下表所示,当溶液的pH达到完全沉淀值时,可以认为金属阳离子已完全沉淀。
氢氧化物 | 完全沉淀时的pH |
Mg(OH)2 | 10.8 |
Fe(OH)2 | 9.6 |
Fe(OH)3 | 3.7 |
Al(OH)3 | 4.7 |
(1)写出加热溶解中发生反应的其中一个化学方程式:____。
(2)滤液2中大量存在的金属离子是___。
(3)调节两次pH值的原因是___。
(4)利用Mg(OH)2与含SO2和O2的烟气反应生成MgSO4和另一种无污染的化合物,可以使烟气脱硫,请问另一种产物的化学式为___。