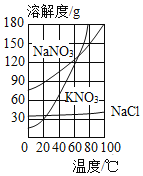
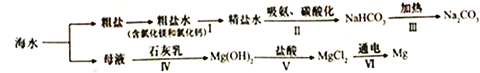
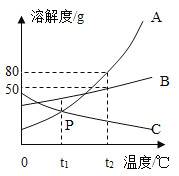
题目内容
【题目】某化学兴趣小组的同学清理实验室时发现一瓶乙醇试剂,标签如图。

(1)C2H5OH中碳元素和氢元素的质量比为________(用最简整数比表示)。
(2)这瓶乙醇试剂的质量为_______g。
(3)现要配制2000 g溶质的质量分数为40%的乙醇溶液,需要乙醇试剂的质量为_______g,需要这种乙醇试剂_____瓶。
【答案】4:1 160 800 5
【解析】
(1)C2H5OH中碳元素和氢元素的质量比=(12×2):(1×6)=4:1,
(2)标签表明,该瓶乙醇的体积为200mL,密度为0.8g/mL,该瓶乙醇的质量=200mL×0.8g/mL=160g;
(3)设:需要溶质质量分数为40%的乙醇的质量为x。则有:
2000g×40%=x
x=800g
需要这种乙醇试剂的瓶数为:800g÷160g=5。

 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案【题目】某化学兴趣小组对“NaOH 溶液与稀盐酸是否恰好完全反应”进行探究;请你参与他们的探究活动,并回答有关问题。
![]()
(1)方案一:某同学按如图所示的方法先向试管中加入约2mLNaOH 溶液,再滴入几滴酚酞溶液,溶液变红.然后慢慢滴入稀盐酸,边滴边振荡,直至溶液恰好变为_____色,证明NaOH溶液与稀盐酸恰好完全反应。
①请指出如图操作中的错误_____。
②写出NaOH溶液与稀盐酸反应的化学方程式_____。
(2)方案二:
实验步骤 | 实验现象 | 结论 |
取2mLNaOH 溶液于试管中,滴入一定量的稀盐酸, 振荡后加入镁条 | 若_____ | 稀盐酸过量 |
若没有明显现象 | NaOH 溶液与稀盐酸恰好完全反应 |
实验反思:
(3)方案一在滴入稀盐酸的过程中,若观察到有少量气泡出现,则产生气泡的原因可能是_____(写出一条即可)。
(4)有同学提出方案二不能证明 NaOH 溶液与稀盐酸恰好完全反应,其原因是_____。
(5)请举一例说明中和反应在生产生活中的应用_____。
【题目】小明同学为了探究某赤铁矿的纯度,先后进行了三次实验,实验数据如下表
实验次数 | 第一次 | 第二次 | 第三次 |
所取铁矿石样品的质量/g | 20 | 20 | 40 |
所加稀硫酸的质量/g | 500 | 400 | 300 |
烧杯内剩余固体的质量/g | 4 | 4 | 24 |
根据晓明同学的实验,试回答以下问题: (赤铁矿石样品中所含杂质不与其它任何物质反应也不溶于水)
(1)实验中发生反应的化学方程式为___________。
(2)此赤铁矿石样品的纯度为____________。
(3)根据已知条件列出求解第三次实验中参加反应的硫酸质量(x) 的比例式____________。
(4)如果用98%的浓硫酸配制第二次实验所用稀硫酸,需加水的质量为__________________。
(5)将第三次实验后烧杯内物质过滤,向所得不饱和滤液中加入184g水后,则所得溶液的溶质质量分数为__________________。
(6)如果将第三次实验中的剩余固体经洗涤、干燥,并用足量的一氧化碳进行还原,则最终可得到固体的质量为__________________。