题目内容
【题目】工业生产纯碱中常含有少量 NaCl 杂质,先称取 12g 纯碱样品放入烧杯中,加入100g 水使其完全溶解,向其中不断滴加氯化钙溶液,测得加入氯化钙质量与生成沉淀质量如图所示。

(1)样品中碳酸钠的质量 。
(2)a 点时,对应溶液中溶质有 。
(3)试计算恰好完全反应时,反应后溶液中溶质的质量分数。(精确到 0.1%)
【答案】(1)10.6g
(2)碳酸钠、氯化钠
(3)5.8%
【解析】
(1)解:设样品中碳酸钠的质量为x,反应后生成氯化钠的质量为y
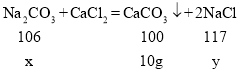
![]() x=10.6g
x=10.6g
![]() y=11.7g
y=11.7g
答:样品中碳酸钠的质量为10.6g;
(2)向纯碱样品中不断滴加氯化钙,氯化钙与碳酸钠反应生成碳酸钙和氯化钠,a点时碳酸钠未完全反应,故a点时,对应溶液中的溶质有:氯化钠、碳酸钠;
(3)恰好完全反应时,反应后溶液中溶质的质量分数为:![]()
答:恰好完全反应时,反应后溶液中溶质的质量分数为5.8%。

【题目】某化学兴趣小组对“NaOH 溶液与稀盐酸是否恰好完全反应”进行探究;请你参与他们的探究活动,并回答有关问题。
![]()
(1)方案一:某同学按如图所示的方法先向试管中加入约2mLNaOH 溶液,再滴入几滴酚酞溶液,溶液变红.然后慢慢滴入稀盐酸,边滴边振荡,直至溶液恰好变为_____色,证明NaOH溶液与稀盐酸恰好完全反应。
①请指出如图操作中的错误_____。
②写出NaOH溶液与稀盐酸反应的化学方程式_____。
(2)方案二:
实验步骤 | 实验现象 | 结论 |
取2mLNaOH 溶液于试管中,滴入一定量的稀盐酸, 振荡后加入镁条 | 若_____ | 稀盐酸过量 |
若没有明显现象 | NaOH 溶液与稀盐酸恰好完全反应 |
实验反思:
(3)方案一在滴入稀盐酸的过程中,若观察到有少量气泡出现,则产生气泡的原因可能是_____(写出一条即可)。
(4)有同学提出方案二不能证明 NaOH 溶液与稀盐酸恰好完全反应,其原因是_____。
(5)请举一例说明中和反应在生产生活中的应用_____。