题目内容
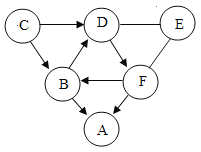
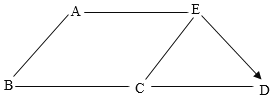
【题目】A~E是初中化学常见的五种不同类别的物质。A是世界年产量最高的金属,C常用于改良酸性土壤。它们相互之间的关系如图所示。“一”表示两种物质之间可以相互反应,“→”表示一种物质可以生成另一种物质。
请回答下列问题:
(1)物质E的化学式是______(写一个即可),A与E能发生反应的原因是_____。
(2)B与C反应的现象是______,C与E反应的实质是_______。
(3)E→D的化学反应方程式是____(写一个即可)。
【答案】HCl(或H2SO4) 在金属活动性顺序里,铁(Fe)排在氢(H)前(或在金属活动顺序里,位于氢前面的金属能置换出盐酸、稀硫酸中的氢) 产生蓝色(絮状)沉淀 氢离子和氢氧根离子结合成水分子(或![]() )
) ![]()
【解析】
目前世界上年产量最高的金属是铁,故A是铁。氢氧化钙常用于改良酸性土壤,故C是氢氧化钙。物质E可以与铁反应,也可以与氢氧化钙反应,且E可以生成D、D可以与C反应,可以推测E是酸,D是二氧化碳。B既可以与铁反应,也可以与氢氧化钙反应,则B可以是氯化铜、硫酸铜等含有铜离子的溶液。
(1)E是某种酸,故E的化学式为HCl(或H2SO4);铁能与酸发生反应的原因是在金属活动性顺序里,铁(Fe)排在氢(H)前(或在金属活动顺序里,位于氢前面的金属能置换出盐酸、稀硫酸中的氢)。
(2)B与C反应是氢氧根与铜离子结合,生成氢氧化铜沉淀,反应现象是:产生蓝色(絮状)沉淀;酸碱中和反应的实质是氢离子和氢氧根离子结合成水分子(或![]() )。
)。
(3)E→D的反应是酸与碳酸钙发生反应,因此化学方程式为:![]() 或
或![]()

 挑战100单元检测试卷系列答案
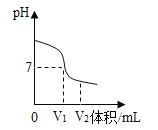
挑战100单元检测试卷系列答案【题目】某同学在帮助实验员整理化学试剂时发现了一瓶标签残缺的无色溶液(如图甲所示),经实验员分析可知原瓶溶液中的溶质可能是NaCl、NaOH、Na2CO3、NaHCO3中的一种,为确认溶液中的溶质,他设计并进行了如下探究活动。
(资料查阅)上述四种物质的相关信息如下:
物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
常温下的溶解度/g | 36 | 109 | 21.5 | 9.6 |
常温下稀溶液的pH | 7 | 13 | 11 | 9 |
请回答下列问题:
(实验探究1)
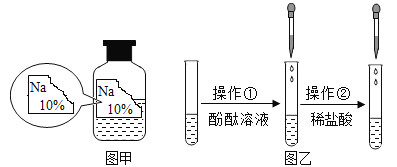
如上图乙所示,在操作①后可确定溶质不是NaCl,则实验现象应是______;在进行操作②时有无色无味气体产生,由此又可排除的物质是__________。
(探究结论)分析四种物质的相关信息,你认为该溶液中的溶质可能是上述四种物质中的______,你的判断依据是__________。若上述探究结论是正确的,操作②发生反应的化学方程式为_____________。
(讨论质疑)有同学认为以上分析不严密,需要进一步实验确定,于是又进行了如下探究。
(实验探究2)向操作①后试管中的溶液中滴加过量CaC12溶液(中性),充分反应后,试管中溶液颜色不变,又有白色沉淀产生。
(得出结论)通过实验探究2可确定原瓶溶液中的溶质应该是_________。
(反思拓展)造成该溶液出现上述实验现象的原因是______________(用化学方程式表示)。
【题目】某校学习小组的同学为了测定某石灰石中碳酸钙的质量分数,他们取该石灰石样品10g加入烧杯中,再把80g稀盐酸分四次加入,实验过程所得数据如下表(已知石灰石样品中含有的杂质既不溶于水,也不与稀盐酸反应):
实验次数 | 第1次 | 第2次 | 第3次 | 第4次 |
加入稀盐酸的质量/g | 20 | 20 | 20 | 20 |
剩余固体的质量/g | 7 | 4 | 2.6 | m |
分析表中数据,完成下列问题:
(1)表中m的数值为_____g;
(2)该石灰石样品中碳酸钙的质量分数为_____;
(3)计算反应所用稀盐酸溶质质量分数_____。