题目内容
【题目】现有含氯化钠杂质的碳酸钠样品,取6.95g样品溶于水,配制成52.2g溶液。此溶液与50g某溶质质量分数的盐酸恰好完全反应,得到100g溶液。请分析计算:
(1)生成二氧化碳的质量是多少。
(2)所得溶液中溶质的质量分数(写出计算过程)。
【答案】(1)2.2g;(2)7.5%。
【解析】
(1)由题意含氯化钠杂质的碳酸钠样品与稀盐酸反应,碳酸钠与稀盐酸反应生成氯化钠、二氧化碳和水,生成的二氧化碳气体逸出反应体系,反应前后溶液质量的减少量即为生成的二氧化碳的质量,则生成二氧化碳的质量是52.2g+50g-100g=2.2g。
(2)由题意碳酸钠与稀盐酸反应生成氯化钠、二氧化碳和水,生成的二氧化碳的质量为2.2g,设参加反应的碳酸钠的质量为![]() ,生成氯化钠的质量为
,生成氯化钠的质量为![]() ,则有:
,则有:
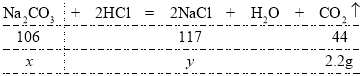
由![]() 解得
解得![]()
由![]() 解得
解得![]()
则所得溶液中溶质的质量分数为![]()
答:所得溶液中溶质的质量分数为7.5%。

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目