题目内容
【题目】酸碱盐种类繁多,与人类日常生活和工农业生产关系十分密切。
(1)酸具有相似的性质,因为不同的酸在水溶液中都能解离出______。
(2)检验敞口放置的氢氧化钠溶液是否变质,可以选用的一种试剂是_____。
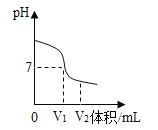
(3)利用数字化实验设备,测定盐酸与氢氧化钠溶液反应时溶液pH变化,实验结果如图,当滴入溶液为V2mL时,所得溶液中溶质化学式为_______,所得溶液能使紫色石蕊溶液变成_____色。
(4)氯化钠是生活中常见的盐,为除去某粗盐水中的MgCl、CaCl2杂质,得到NaCl溶液,某化学小组设计了如下实验方案。
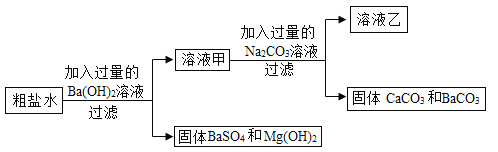
①过滤操作中所用到的玻璃仪器有烧杯、漏斗和____________.
②以上方案中有关反应的化学方程式为__________(写一个即可)
③写出溶液乙中含有的杂质,并将以上方案补充完整_______。
(5)某实验室用40g、20%的NaOH溶液洗涤一定量石油产品中残余的H2SO4,消耗NaOH溶液呈中性,请计算该一定量石油产品H2SO4的质量________。
【答案】H+ 稀盐酸(或者稀硫酸、BaCl2溶液,CaCl2溶液等) HCl、NaCl 红 玻璃棒 Ba(OH)2 +MgSO4=BaSO4↓+Mg(OH)2↓(或者Ba(OH)2 +Na2CO3=BaCO3↓+2NaOH,CaCl2 +Na2CO3= CaCO3↓+2NaCl) Na2CO3和NaOH在溶液乙中加入适量稀盐酸 9.8g
【解析】
(1)酸具有相似化学性质的原因是都能在水溶液中解离出H+。
(2)氢氧化钠变质产生了碳酸钠,即检验是否有Na2CO3, 可引入H+,Ba2+,Ca2+,可用稀盐酸、稀硫酸、BaCl2溶液,CaCl2溶液等,酸能与碳酸钠反应生成二氧化碳,有气泡产生,氯化钙能与碳酸钠反应生成碳酸钙白色沉淀;
(3)由图像可知V2mL对应点的pH在7的下面,呈酸性,即酸过量,有HCl,反应产生了NaCl,故溶液中溶质为HCl和NaCl。酸性溶液能使石蕊溶液变红。
(4)①过滤用到的仪器有烧杯、漏斗、玻璃棒
②考察复分解反应的书写,粗盐提纯常见化学方程式。
整个过程发生的化学方程式有Ba(OH)2+MgSO4=BaSO4↓+Mg(OH)2↓
(或者Ba(OH)2+Na2CO3=BaCO3↓+2NaOH,CaCl2 +Na2CO3= CaCO3↓+2NaCl),写出一个即可。
③整个过程中,引入的除杂试剂Na2CO3未被去除,且Na2CO3和Ba(OH)2反应产生了NaOH, 故杂质有Na2CO3和NaOH,除去需在溶液乙中加入适量稀盐酸,题干标明是“得到NaCl溶液”,故应写“适量稀盐酸”,且不得写“蒸发结晶”。
(5)解:设该一定量石油产品中硫酸的质量为x
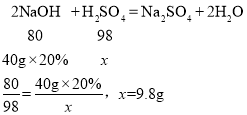
答:该一定量石油产品中硫酸的质量为9.8g。

 高效智能课时作业系列答案
高效智能课时作业系列答案