题目内容
【题目】硫酸镁和硫酸的混合溶液中,硫元素的质量分数占4.8%。向100g该混合溶液中加入氢氧化钠溶液,恰好完全反应,测得消耗氢氧化钠溶液的质量为100g。下列说法不正确的是
A.氢氧化钠溶液中溶质质量分数为12.0%
B.所得溶液中溶质质量为21.3g
C.生成氢氧化镁沉淀的质量为8.7g
D.氢氧化钠溶液中钠元素质量为6.9g
【答案】C
【解析】
向硫酸镁与硫酸的混合溶液中加入氢氧化钠溶液,会发生两个化学反应![]() 和
和![]()
设钠元素的质量为![]() ,生成的硫酸钠的质量为
,生成的硫酸钠的质量为![]() ,氢氧化钠溶液中溶质的质量分数为
,氢氧化钠溶液中溶质的质量分数为![]() ,由
,由![]() 和
和![]() 可得出关系:
可得出关系:
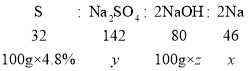
![]() ;
; ![]() ;
; ![]()
解得:![]() =6.9g,
=6.9g,![]() =21.3g,
=21.3g,![]() =12%
=12%
A、由分析中得出的数据可知,![]() =12%,则氢氧化钠溶液中溶质的质量分数为12%,故A选项说法正确;
=12%,则氢氧化钠溶液中溶质的质量分数为12%,故A选项说法正确;
B、生成的硫酸钠的质量为![]() =21.3g,恰好完全反应,则溶液中溶质为硫酸钠,溶质质量为21.3g,故B选项说法正确;
=21.3g,恰好完全反应,则溶液中溶质为硫酸钠,溶质质量为21.3g,故B选项说法正确;
C、假设当原混合溶液中溶质完全是硫酸镁的时候,可以生成的氢氧化镁沉淀质量为![]()
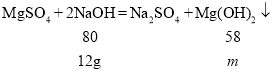 解得
解得![]() =8.7g
=8.7g
然而已知溶液是硫酸镁与硫酸的混合溶液,生成的氢氧化镁质量一定小于8.7g,故C选项说法错误;
D、根据分析中的计算,钠元素的质量为![]() =6.9g,故D选项说法正确。
=6.9g,故D选项说法正确。
故选C。

【题目】为了除去二氧化碳中的少量氧气,并进行有关碳及氧化物的实验。某同学用如图所示装置,在完成气密性检查后加入药品,并已在装置中充满二氧化碳。
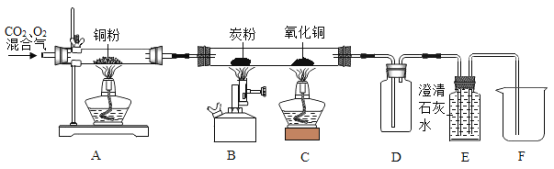
(1)将表格空白处该填写的内容,在答题卷上,按标号顺序对应填写:
实验步骤 | 实验现象 | 实验分析 |
Ⅰ:点燃A处酒精灯,缓缓通入混合气体。 | A中铜粉______,B、C、D无明显现象,E中石灰水变浑浊。 | A玻璃管中铜粉的作用是除去CO2中的氧气。 |
Ⅱ:点燃B处酒精喷灯,加热段时间。 | 木炭粉______,E中澄清石灰水变浑浊,F中有液体流入。 | B处发生反应的化学方程式_______________ |
Ⅲ:点燃C处酒精灯。 | C处的现象是__________,E中澄清石灰水变浑浊,F中有液流入。 | c处是检验B处的产物 |
IV:停止通入混合气体,用弹簧夹夹紧进气口,熄灭A、B、C三处火焰。 | D中的现象_________ | D的作用是________ |
(2)有同学认为该装置需要添加尾气处理装置,你认为_________(填“需要”或“不需要”)理由是:___________________。