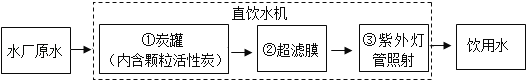
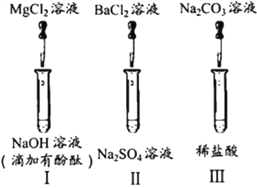
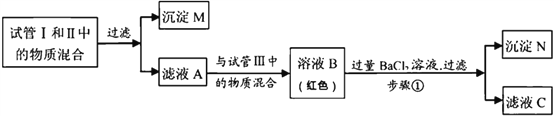
题目内容
【题目】由128克硝酸钾、60克氯化钠组成的混合物投入200g热水溶解,对该溶液进行如图实验(假设实验过程中无损耗):
温度(℃) | 10 | 20 | 30 | 40 | 60 | 80 | 100 | |
溶解度 | 硝酸钾 | 20.9 | 31.6 | 45.8 | 64 | 110 | 169 | 246 |
氯化钠 | 35.8 | 36 | 36.3 | 35.4 | 37 | 38.4 | 39.8 | |
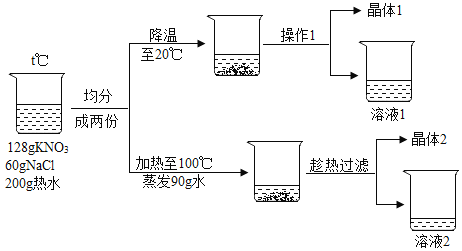
(1)两种物质溶解在水中,用玻璃棒搅拌的目的是________________。
(2)实验时温度t的范围为________________。
(3)操作1用到的玻璃仪器除玻璃棒以外还有_________________。
(4)请定量描述晶体1的组成(忽略操作中的误差)_____________。
(5)溶液2为__________________(填物质名称)的饱和溶液。
(6)关于溶液1和溶液2中溶解的NaCl的质量大小关系:溶液 1 _________溶液2 (选填“>”、“<”或“=”)。
(7)关于上述实验说法错误的是______________。
A晶体1与晶体2比较,晶体1中KNO3的纯度更高
B溶液1中KNO3为饱和溶液,NaCl为不饱和溶液
C溶液1恒温蒸发90g水后,与溶液2的溶质质量相同
【答案】加速溶解 大于等于40℃ 烧杯、漏斗 32.4g硝酸钾 氯化钠和硝酸钾的饱和溶液 > C
【解析】
(1)两种物质溶解在水中,用玻璃棒搅拌的目的是加速溶解;
(2)实验时,128克硝酸钾、60克氯化钠组成的混合物投入200g热水中两种物质必须全部溶解,根据两种物质的溶解度,温度t的范围为大于等于40℃;
(3)操作1能将固体和液体分离,操作名称是过滤,用到的玻璃仪器除玻璃棒以外还有烧杯、漏斗;
(4)20℃时,硝酸钾的溶解度是31.6g,氯化钠的溶解度是36g,不会析出氯化钠,所以定量描述晶体1的组成是:(64g-31.6g)=32.4g硝酸钾;
(5)100℃时,硝酸钾的溶解度是246g,氯化钠的溶解度是39.8g,根据溶解度概念,10g水中最多溶解24.6g硝酸钾、3.98g氯化钠,蒸发90g水后,硝酸钾、氯化钠都析出,析出晶体后的溶液仍是饱和溶液,所以溶液2为氯化钠和硝酸钾的饱和溶液;
(6)溶液1中氯化钠没有析出,溶液2中析出的晶体中含有氯化钠,关于溶液中NaC1的质量分数:溶液1>溶液2;
(7)A 晶体1只有KNO3,晶体2中存在NaCl和KNO3,晶体1中KNO3的纯度更高,故A正确;
B 20℃时,硝酸钾的溶解度是31.6g,氯化钠的溶解度是36g,所以溶液1中KNO3为饱和溶液,NaCl是不饱和溶液,故正确;
C 溶液1恒温蒸发90g水后,与溶液2的成分不相同,溶液1已经先析出了硝酸钾晶体,故错误。故选C。