题目内容
【题目】金属材料包括纯金属以及它们的合金。
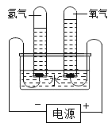
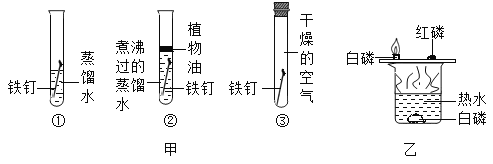
(1)徒步旅行,经常需要在野外过夜。搭建帐篷的撑杆多为铝合金。不采用金属铁作为支撑杆的原因是:铁与_____和_____,同时接触易发生锈蚀,铝的活动性比铁强,但铝在空 气中却表现出良好的抗腐蚀性能,请用化学方程式表述其原因:_____。
(2)自行车作为常用的代步工具,既轻便灵活又符合环保要求,其中车架表面刷漆主要是为了防锈,其原理是_____。
(3)为了验证铁、铝、铜的金属活动性顺序,某同学选择了打磨过的铁丝,他还需要选择的两种盐溶液是_____。写出实验中发生反应的化学方程式:_____。
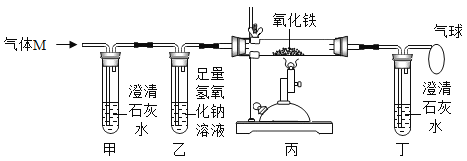
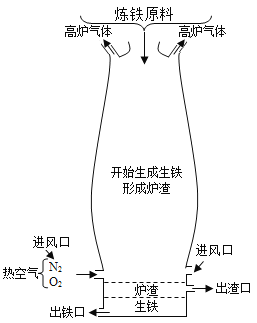
(4)炼铁的原理是利用一氧化碳与氧化铁的反应,化学方程式为_____,该反应中一氧化碳表现出_____(填“氧化性”或“还原性”)。如图是炼铁高炉示意图,写出原料焦炭的一个作用_____。
(5)5g某钢样在纯氧中完全燃烧,得到 0.33g 二氧化碳。求此钢样中碳的质量分数_____。(写出计算过程)
【答案】水 氧气 4Al+3O2═2Al2O3 使铁与水和氧气隔绝 硫酸铜溶液和硫酸铝溶液 Fe+CuSO4=FeSO4+Cu Fe2O3+3CO![]() 2Fe+3CO2 还原性 得到还原剂一氧化碳或提供热量 1.8%
2Fe+3CO2 还原性 得到还原剂一氧化碳或提供热量 1.8%
【解析】
(1)铁锈蚀的主要条件是与水和氧气同时接触;Al易与O2反应生成致密的氧化膜,从而表现出良好的抗腐蚀性能。化学方程式表述其原因为:4Al+3O2═2Al2O3;
(2)车架表面刷油漆能使铁与水和氧气隔绝,达到防锈目的,故答案为:使铁与水和氧气隔绝;
(3)由铝、铜、铁的金属活动性顺序可以知道,在有铁丝的情况下来验证这三种金属的活动性顺序,应选择硫酸铜溶液和硫酸铝溶液,铁丝和硫酸铝溶液不反应,说明铝比铁丝活泼,铁丝和硫酸铜溶液反应生成硫酸亚铁和铜,说明铁比铜活泼,反应的化学方程式为:Fe+CuSO4=FeSO4+Cu;
(4)一氧化碳和氧化铁在高温的条件下生成铁和二氧化碳,反应的化学方程式为:Fe2O3+3CO![]() 2Fe+3CO2;在该反应中一氧化碳得到氧发生氧化反应,具有还原性;如图是炼铁高炉示意图,写出原料焦炭的一个作用:得到还原剂一氧化碳或提供热量;
2Fe+3CO2;在该反应中一氧化碳得到氧发生氧化反应,具有还原性;如图是炼铁高炉示意图,写出原料焦炭的一个作用:得到还原剂一氧化碳或提供热量;
(5)解:设碳的质量为x,

x=0.09g,
钢样中碳的质量分数为:![]() ×100%=1.8%
×100%=1.8%
答:此钢样中碳的质量分数为1.8%。

【题目】由128克硝酸钾、60克氯化钠组成的混合物投入200g热水溶解,对该溶液进行如图实验(假设实验过程中无损耗):
温度(℃) | 10 | 20 | 30 | 40 | 60 | 80 | 100 | |
溶解度 | 硝酸钾 | 20.9 | 31.6 | 45.8 | 64 | 110 | 169 | 246 |
氯化钠 | 35.8 | 36 | 36.3 | 35.4 | 37 | 38.4 | 39.8 | |
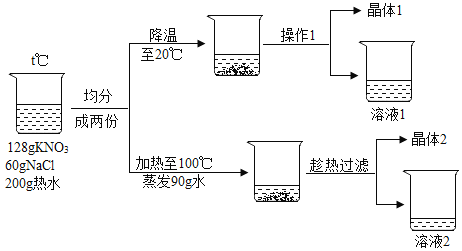
(1)两种物质溶解在水中,用玻璃棒搅拌的目的是________________。
(2)实验时温度t的范围为________________。
(3)操作1用到的玻璃仪器除玻璃棒以外还有_________________。
(4)请定量描述晶体1的组成(忽略操作中的误差)_____________。
(5)溶液2为__________________(填物质名称)的饱和溶液。
(6)关于溶液1和溶液2中溶解的NaCl的质量大小关系:溶液 1 _________溶液2 (选填“>”、“<”或“=”)。
(7)关于上述实验说法错误的是______________。
A晶体1与晶体2比较,晶体1中KNO3的纯度更高
B溶液1中KNO3为饱和溶液,NaCl为不饱和溶液
C溶液1恒温蒸发90g水后,与溶液2的溶质质量相同