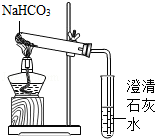
��Ŀ����
�����İְ����ι���������һЩ������ʯ����������������ͬѧ������֤����ʯ����Ҫ�ɷ���̼���Σ��������ǽ�����һ������ʯ����ʵ���ҽ���̽����
��1��������������������̽��������
| ʵ����� | Ԥ�ڵ�ʵ������ | ʵ����� |
| ��ȡһС������ʯ���Թ��У����Թ��м����� �����۲����� ���� �����۲����� | ���������� �� �� | ����ʯ����Ҫ�ɷ���̼���� |
��2���������ϵ�֪����ʯ����Ҫ�ɷ���̼��ƣ��������ʲ�����ˮ�Ҳ����ᷢ����Ӧ��������Ԥ�ڵ�ʵ�����������������ɵķ�Ӧ�Ļ�ѧ����ʽΪ�� ����
��3��ʵ���Ϊ�˷�ֹ��Һ��ʴ��ˮ�ܵ����ˮ�ʲ�������Ӱ�죬���������еķ�Һ������һ���ྻ���ձ��У���ȡ���ⶨ�˷�Һ������ԣ�����Ϊ��ѡ����Լ��������� �������Ժ��֪�÷�Һ�����ԣ����ձ��з�Һ���������� ����
��4���������ձ��еķ�Һ������������ ��������ţ���ʹ��Һ�����ԣ����˺�ſɰ�ȫ�ŷţ�
��̼��� ����ʯ�� ����ʯ�� ����������
��1��
��2��CaCO3+2HCl=CaCl2+H2O+CO2��ʵ����� Ԥ�ڵ�ʵ������ ��ϡ����
�ڽ�����������ͨ������ʯ��ˮ������ʯ��ˮ�����
��3��ʯ����Һ����pH��ֽ�� �Ȼ��ƺ��Ȼ��⣨��CaCl2��HCl�� ��4����
���������������1������̼������ӵķ���Ϊ������ϡ���ᣬ̼������ӻ��ϡ���ᷴӦ�����ɶ�����̼���壬������̼��ʹ����ʯ��ˮ����ǣ�
��2��̼��ƻ���ϡ���ᷴӦ�����ɶ�����̼���塢ˮ���Ȼ��ƣ���Ӧ�ķ���ʽΪ��CaCO3+2HCl=CaCl2+H2O+CO2��
��3���ⶨ��Һ������Կ���ͨ��ʯ����Һ��ɺ�ɫ����ɫ������ɫ����֤����Ҳ������pH��ֽ�ⶨ��Һ��pH�Ǵ���7��С��7���ǵ���7��֤������Ϊ�ⶨ�����Һ�����ԣ�˵�����������ͬʱ��Һ�л������ɵ��Ȼ��ƣ�
��4����ʯ�ҡ���ʯ�Һ��������ƶ��ܹ������ᷴӦ�������������۲췴Ӧ�ij̶ȣ���̼��ƺ����ᷴӦ�������ݣ���û�����ݲ���ʱ��˵����Ӧ�꣬��̼��ƹ������������������Ӱ����Һ������ԣ���ѡ��٣�
���㣺֤��̼���Σ���Ļ�ѧ���ʣ���Һ������Բⶨ����д��ѧ����ʽ�����ֱ���ʽ�����뷽��ʽ��
�������������й�̼������ӵļ��鼰��Һ������Լ��顢���ӵȵĿ��飬����̼������ӵļ��鷽�������ӵ�ԭ���ǽ������Ĺؼ���

ʵ����ϣ�С��ͬѧ��ʢ�г���ʯ��ˮ���ձ��м��������̼������Һ�����ɰ�ɫ���������˺�õ���ɫ��Һ����˵�������Ƶ�������������Һ����
��1��С��ͬѧȴ˵����������ɫ��Һ�в�һ�������������ơ�����������ʵ�飺
| ʵ�鲽�� | ʵ������ | ʵ����� |
| ���Թ�ȡ��ɫ��Һ����������2����ɫ��̪��Һ | ��ɫ��̪��Һ��� | ��ɫ��Һ�к����������� |
С����ΪС����ʵ�鷽��Ҳ�����ܣ�����֤ʵ��ɫ��Һ��һ�������������ƣ������ǣ� ��
��2��С���������һ��ʵ�飺
| ʵ�鲽�� | ʵ������ | ʵ����� |
| ��ȡ������Ʒ���Թ��У����� �ڹ��ˣ�����Һ�еμӼ�������ͭ��Һ | �� �� | ��ɫ��Һ��ȷʵ������������ |
��3��С���ʵ��ɿ��Ըߵ�ԭ���Ǣ� ���� ��
��ѧ��ȤС��ͬѧ����ʵ��̨�ϰ���ͼ��ʾ˳��ڷ���6ƿ��ͬ����ɫ��Һ����ͼ��ʾ��A��B��C��D��E��F������Ӧ����Һ��������E��Һ���Լ�ƿ��ǩ����Ϊ�ˣ�������������̽����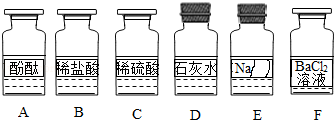
��������⡿E��Һ�ijɷ���ʲô��
�������жϡ����������ǩ��ʵ����ҩƷ����ڷ�ԭ��E��Һ���������� ��������ţ�������ڼ���Σ�
��������롿�����NaOH��Һ�������Na2CO3��Һ�������Na2SO4��Һ����������� ����Һ����дһ�֣���
����Ʋ�ʵ�顿��ȤС���ͬѧΪ��֤��������Ƿ���ȷ����Ʋ�������±���ʾʵ�飮
| ʵ�鷽�� | ʵ��һ | ʵ��� | ʵ���� |
| ʵ����� | 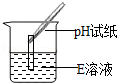 | 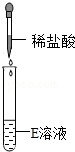 |  |
| ʵ������ | ��ֽ��ɫ�����ձ�ɫ����pH��7 | ����ɫ��ζ������� | ���а�ɫ���������� |
| ʵ����� | �������ȷ | ||
��������������
����ɡ�ʵ��һ�������ͬѧ����Ϊ���������ȷ����ƽͬѧ��Ϊ�������һ����ȷ�������������� �� ��
�ںθ�ͬѧ��Ϊֻ��Ҫ��ɡ�ʵ��������ɵó����������ȷ�Ľ��ۣ�����Ϊ��˵���� ������������������������������� ����
����д����ʵ�������з�����Ӧ�Ļ�ѧ����ʽ�� ����
����˼�����ۡ�
�������ۣ�ͬѧ����Ϊ��ʵ��һ���������Բ������ô������� �����۲췢��D��E�Լ�ƿ��ƿ����������ʹ��������ԭ������ ����
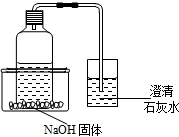
�ڻ�ѧʵ���ң�С�պ�Сǿ���ⷢ��ʵ��������һƿ���ڷ��õ��������ƹ��壬���Ƕ���ƿ�������ƹ����Ƿ���ʽ���������ʵ��̽����
��������⡿��ƿ�������ƹ����Ƿ���ʣ�
��������¶���ڿ����лᷢ�����ʣ����ʵ�ԭ������ �����û�ѧ����ʽ��ʾ����
��ʵ��̽����Ϊ������ƿ�������ƹ����Ƿ���ʣ�С�պ�Сǿ���������ʵ�鷽����
С�գ�ȡ������Ʒ����������ˮ�����Һ���뼸�η�̪��Һ�����۲쵽��Һ���ɫ��֤����ƿ�������ƹ���û�б��ʣ�
Сǿ��ȡ������Ʒ����������ˮ�����Һ������������ʯ��ˮ�����۲쵽�а�ɫ�������ɣ�֤����ƿ�������ƹ����Ѿ����ʣ�
����Ϊ����ʵ�鷽����������� ������������ ����
�����������һ��������֤����ƿ�������ƹ����Ѿ����ʣ����������ʵ�鱨�棺
| ʵ�鲽�� | ʵ�������� |
| �� �� | �� �� |
��������˼����ʵ����������������Ҫ�ܷⱣ�森ҩƷ�ܷⱣ���ԭ��ܶ࣬����д��Ũ������Ҫ�ܷⱣ���ԭ���� ����
�������ڶ�����������Դʮ�ַḻ���Ӻ�ˮ����ȡ�Ȼ��Ʋ����Ȼ��ƺ�ˮΪԭ����ȡ�������ơ����������ʵĹ�������ͼ���£�
ij��ȤС���������ʵ�飺
��ʵ��һ����ȥ�����еIJ���������
����һ����������ƽ��ȡ5.0g���Σ���ҩ���ô�������ʢ10mLˮ���ձ��У��ӱ��ò��������裬һֱ�ӵ����β����ܽ�Ϊֹ������ʣ�µĴ�������Ϊ1.4g
��������������ˡ��������õ�3.2g���Σ�
��1�����㾫�εIJ����� ��������һλС������
��2����С���õIJ���ƫ�ͣ����ܵ�ԭ������ ����
A���ܽ�ʱδ��ֽ���
B������ʱˮ��δ����
C������ʱ��������������
��3������һ�����IJ��ֲ�����ͼ��ʾ�����д�������� ��������ĸ��ţ���
��ʵ�����̽����������ͼ��������õ��Ȼ�����Һ��MgCl2�Ƿ��������Һ���Ƿ���CaCl2
[��������]�й����ʵ��ܽ��Ա���20�棩
| ������ ������ | OH�� |  |
| Ca2+ | | �� |
| Mg2+ | �� | |
| ʵ�鲽�� | ʵ������ | ʵ����� |
| ����һ��ȡһ�������Ȼ�����Һ���Թ��У�����������NaOH��Һ | ���������� | ˵��MgCl2�� ������ѡ���δ�������� |
| �������������һ������Һ�м����������� ����Һ | ������ɫ���� | ˵����Һ�к���CaCl2 |
��1����������ͼ�����Ӻ�ˮ�еõ����Σ����÷紵��ɹ�����ܼ��ķ����������Dz��ý�����Һ�¶ȵķ�����ԭ������ ����
��2��д����������ͼ������Ļ�ѧ����ʽ�� ����
����˵����ȷ����
| A����ʯ���Ƴɵĸ��������ʳ�� |
| B��ֱ��Ʒ��ʵ����ҩƷ��ζ�� |
| C����ʳ�ؽ����Σ��ɷ�ţ�̻���ⶾ |
| D��Һ�������Ѹ�ٹرշ��ţ��ԶϾ���ȼ�����Դ |