题目内容
【题目】氯化钠是重要的调味品,是舌尖上最不可缺少的味道。下面三幅示意图分别表示不同的化学反应,但生成物中都有氯化钠。
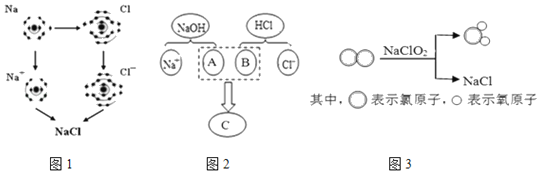
(1)图1是金属钠与氯气反应生成氯化钠的微观示意图。由图1可知,构成氯化钠的微粒是_____(选填“分子”、“原子”或“离子”)。
(2)图2描述了NaOH溶液与盐酸反应的微观实质,图中A、B、C处应填入的化学式或离子符号依次为_____。
(3)图3所示的四种物质中属于氧化物的是_____(填化学式),该反应的化学方程式为_____。
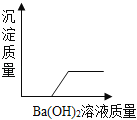
(4)粗盐水中主要含有CaCl2、MgSO4等可溶性余质,可加入下列物质,利用过滤等操作进行除杂。则加入下列三种物质的先后顺序为_____(填序号)。
①适量稀盐酸 ②过量的碳酸钠溶液 ③过量的氢氧化钡溶液
【答案】离子 OH﹣、H+、H2O ClO2 Cl2+2NaClO2═2ClO2+2NaCl ③②①
【解析】
(1)氯化钠是由钠离子与氯离子构成的。构成氯化钠的微粒是离子;
(2)氢氧化钠与盐酸的反应,是两种化合物相互交换成分,此反应的实质是酸中的氢离子和碱中的氢氧根离子结合生成了水分子,氢氧化钠电离出A是氢氧根离子,盐酸电离出的B是氢离子,生成的C是水分子。图中A、B、C处应填入的化学式或离子符号依次为:OH﹣、H+、H2O;
(3)图3中![]() 是由两种元素组成且含有氧元素的化合物,属于氧化物,其化学式为ClO2,该反应的化学方程式为Cl2+2NaClO2═2ClO2+2NaCl;
是由两种元素组成且含有氧元素的化合物,属于氧化物,其化学式为ClO2,该反应的化学方程式为Cl2+2NaClO2═2ClO2+2NaCl;
(4)粗盐水中主要含有CaCl2、MgSO4等可溶性杂质,氯化钙与碳酸钠反应生成碳酸钙和氯化钠,碳酸钠溶液可除去氯化钙;硫酸镁和氢氧化钡生成氢氧化镁和硫酸钡,氢氧化钡溶液可除去硫酸镁;由于加入碳酸钠溶液和氢氧化钡溶液都是过量的,碳酸钠与氢氧化钡反应生成碳酸钡和氢氧化钠,所以碳酸钠应该加在氢氧化钡的后面,盐酸能与氢氧化钠、碳酸钠反应生成氯化钠,盐酸可除去过量的碳酸钠和生成的氢氧化钠,则加入下列三种物质的先后顺序为③②①。

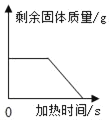
【题目】铜镁合金常用作飞机天线等导电材料。欲测定合金的组成(其他元素忽略不计),进行了以下实验:取出3g合金样品,将60g稀硫酸分为6等份依次加入样品中,充分反应后过滤、洗涤、干燥、称重,得到的实验数据如下:
稀硫酸用量 | 第1份 | 第2份 | 第3份 | 第4份 | 第5份 | 第6份 |
剩余固体质量 | 2.5g | m | 1.5g | 1.0g | 0.6g | 0.6g |
(1)铜镁合金属于_____(填“混合物”或“纯净物“);
(2)加入稀硫酸发生反应的化学方程式为_____;
(3)分析数据可知表格中m=_____;
(4)合金样品中铜的质量分数是_____;
(5)若反应过程中产生的气体收集起来,可得到氢气的质量为多少g?_____