题目内容
(3分)将一定质量的碳酸钠粉末溶于400g水中配制成溶液,取1/4该溶液,向其中加入20%的氯化钙溶液至不再产生沉淀(反应方程式为CaCl2 + Na2CO3 ="==" CaCO3↓+ 2NaCl),所得沉淀的质量与加入氯化钙溶液的质量关系如图所示,试计算碳酸钠粉末的总质量及恰好完全反应时所得溶液中溶质的质量分数。

84.8g 11.0%
试题分析:取1/4该溶液带入计算,则碳酸钠的总质量应为此溶液中碳酸钠的4倍。根据沉淀物(碳酸钙)的质量20g,即可计算出碳酸钠、氯化钙、氯化钠的质量。
[解]设:取出的
 溶液中所含Na2CO3质量为x,所加CaCl2溶液中CaCl2质量为y,生成的NaCl质量为z
溶液中所含Na2CO3质量为x,所加CaCl2溶液中CaCl2质量为y,生成的NaCl质量为zNa2CO3 + CaCl2 CaCO3↓ + 2NaCl
106 111 100 117
x y 20g z
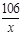 =
= 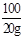 x=21.2g
x=21.2g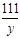 =
= 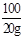 y="22.2g"
y="22.2g" 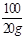 =
= 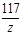 z=23.4g
z=23.4g碳酸钠粉末的总质量为:21.2g×4=84.8g
恰好完全反应时所得溶液中溶质质量分数为:
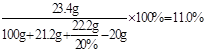
答:碳酸钠粉末的总质量为84.8g;恰好完全反应时所得溶液中溶质的质量分数为11.0%。
点评:要解答此题,首先要分析题中的数量关系,由图像可知,该溶液与氯化钙反应最终生成碳酸钙沉淀的质量是20g;根据化学方程式计算要注意解题的步骤:设、写、找、列、解、答。

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
 K2S + 3CO2↑+ N2↑。若该反应消耗64 g硫,计算生成CO2的质量。
K2S + 3CO2↑+ N2↑。若该反应消耗64 g硫,计算生成CO2的质量。 2AlN。若有54 kg高纯度铝粉,求可制得氮化铝的质量。
2AlN。若有54 kg高纯度铝粉,求可制得氮化铝的质量。