题目内容
(3分) 向盛有32.9g碳酸钠和氯化钠固体混合物的烧杯中逐滴加入CaCl2溶液,生成沉淀的质量与滴入CaCl2溶液的质量关系如下图所示。反应结束后,A点时溶液中氯化钠溶质的质量分数为26%。(已知:Na2CO3+CaCl2=CaCO3↓+2NaCl)请计算:

(1)原固体混合物中碳酸钠的质量分数。
(2)原固体混合物中钠元素和氯元素的质量比。

(1)原固体混合物中碳酸钠的质量分数。
(2)原固体混合物中钠元素和氯元素的质量比。
(1)64.4% (2)138: 71
试题分析:(1)分析本题中所发生的反应为碳酸钠和氯化钙的反应,氯化钠不反应,同时分析图象可知,当沉淀量不再改变时,二者恰好完全反应;则A点时的溶液的溶质是氯化钠(包括原混合物中的氯化钠和反应生成的氯化钠)和过量的CaCl2,已知A点时溶液中氯化钠溶质的质量分数为26%,故可根据溶质质量分数的公式计算。
解:设原固体混合物中碳酸钠的质量为X 。
Na2CO3+CaCl2=CaCO3↓+2NaCl
106 100 117
X
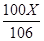
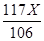
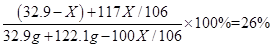
解得,X = 21.2g
碳酸钠的质量分数="(21.2g/32.9g)×100%=64.4%"
(2)原混合物固体中含有碳酸钠和氯化钠,故其中钠元素和氯元素的质量比=碳酸钠中的钠元素和氯化钠中的钠元素的质量之和:氯化钠中氯元素的质量
原混合物固体中氯化钠的质量="(32.9-21.2)g" =11.7g
钠元素与氯元素的质量比=(21.2×46/106+11.7×23/58.5)g:(11.7×35.5/58.5)g
= (9.2+4.6)g: 7.1g=13.8g: 7.1g=138:71
答:原固体混合物中碳酸钠的质量分数为64.4%;原混合物固体中钠元素和氯元素的质量比为138: 71。
点评:本题为根据化学方程式的基本计算,正确的化学方程式是进行计算的基础,规范的书写格式、准确的计算结果则是考试中不失分的关键。

练习册系列答案
相关题目
