题目内容
加热氯酸钾和二氧化锰固体混合物制取氧气时,如果反应前氯酸钾和二氧化锰混合物的质量为3克,加热到不再产生气体为止,剩余固体的质量为2.04克。则:
(1)反应能制得氧气多少克?体积为多少升?(此状态下氧气的密度为1.43克/升)
(2)原混合物中氯酸钾的质量分数为多少?(保留2位小数)
(1)反应能制得氧气多少克?体积为多少升?(此状态下氧气的密度为1.43克/升)
(2)原混合物中氯酸钾的质量分数为多少?(保留2位小数)
(1)0.96克、 0.67升
(2) 81.67%
(2) 81.67%
本题考查的是质量守恒定律及其应用:根据化学反应方程式的计算。本题是实验室制取氧气的反应,原理是氯酸钾分解生成固体氯化钾和气体氧气。二氧化锰是催化剂,反应前后质量并不变化。这样,可知反应后固体质量会减少,减少的正好是氧气的质量。
解:(1)反应能制得氧气质量:3g-2.04g="0.96g" ,则反应能制得氧气体积:0.96g÷1.43g/L="0.67L" 答:反应能制得氧气质量为0.96g,反应能制得氧气体积为0.67L。
(2)设原混合物中氯酸钾的质量为X。
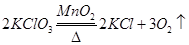
245 96
X 0.96g
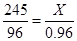 解得X=2.45g
解得X=2.45g
原混合物中氯酸钾的质量分数:
答:原混合物中氯酸钾的质量分数为81.7%
解:(1)反应能制得氧气质量:3g-2.04g="0.96g" ,则反应能制得氧气体积:0.96g÷1.43g/L="0.67L" 答:反应能制得氧气质量为0.96g,反应能制得氧气体积为0.67L。
(2)设原混合物中氯酸钾的质量为X。
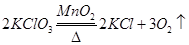
245 96
X 0.96g
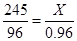 解得X=2.45g
解得X=2.45g原混合物中氯酸钾的质量分数:

答:原混合物中氯酸钾的质量分数为81.7%

练习册系列答案
相关题目

 CO2 + 4H2O,该反应所用燃料符合“绿色化学”的要求,原因是 ;
CO2 + 4H2O,该反应所用燃料符合“绿色化学”的要求,原因是 ;
