题目内容
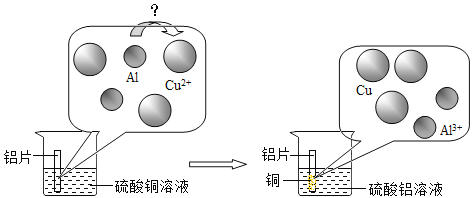
【题目】课外兴趣小组研究发现铜锈 [主要成分Cu2(OH)2CO3,学名:碱式碳酸铜]在加热后,除有二氧化碳和水生成外,在试管底部还有黑色粉末生成,他们对黑色粉末的成分进行了下列探究(不考虑杂质对实验的影响)。
(提出问题)黑色固体的成分是什么?
(提出猜想)①炭粉;②氧化铜;③______________。
(查阅资料)炭粉为黑色固体,不与稀酸反应,也不溶于稀酸。
(进行实验)(1)取少量黑色固体于坩埚中,用酒精灯加热,充分灼烧后,黑色固体无变化,猜想__不成立(填“①”、“②”或“③”,下同);
(2)用试管取少量黑色固体,滴加足量的_____________,振荡,充分反应后,观察到固体全部溶解,溶液显蓝色,猜想_____成立,发生反应的化学方程式是___________________________。
(拓展反思)孔雀石的主要成分与铜锈相同,结合上述实验探究结论,可以得出我国古代用孔雀石与木炭粉混合高温炼铜的反应原理是 __________________________。
【答案】炭粉、氧化铜 ①③ 稀盐酸 ② ![]()
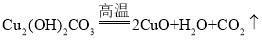 ,
,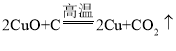
【解析】
高温条件下,炭粉和氧气反应生成二氧化碳,碱式碳酸铜分解生成氧化铜、水和二氧化碳,氧化铜和碳反应生成铜和二氧化碳;氧化铜和盐酸反应生成氯化铜和水。
[提出猜想]①炭粉;②氧化铜;③炭粉、氧化铜。
[进行实验](1)取少量黑色固体于坩埚中,用酒精灯加热,充分灼烧后,黑色固体无变化,说明黑色固体中不含有炭粉,猜想①③不成立。
(2)取少量黑色固体于试管中,滴加足量的稀盐酸,振荡,充分反应后,观察到固体全部溶解,溶液显蓝色,说明氧化铜和盐酸反应生成了氯化铁和水,猜想②成立,发生反应的化学方程式是![]() 。
。
[拓展反思] 高温条件下,碱式碳酸铜分解生成氧化铜、水和二氧化碳,氧化铜和碳反应生成铜和二氧化碳,反应的化学方程式为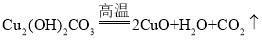 ,
,
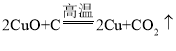 。
。

 名校课堂系列答案
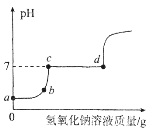
名校课堂系列答案【题目】由于溶解度不同(如图所示),饱和碳酸钠溶液中通入CO 2会析出碳酸氢钠晶体而使溶液变浑浊。某化学课外小组同学发现不同条件下出现浑浊的时间不同。
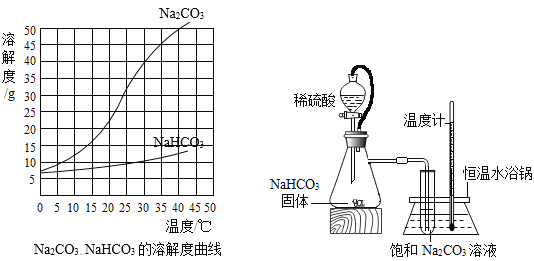
(提出问题)影响碳酸氢钠晶体产生速率的因素有哪些?
(猜想与假设)碳酸氢钠晶体产生速率的影响因素有温度、试管内径、CO2流速、饱和碳酸钠溶液的体积。
(进行实验)实验装置如图所示。每次实验时均在试管里加入1mL饱和碳酸钠溶液并在试管后放置一张写有黑色字迹的白纸,从垂直于试管的方向观察白纸上字迹的清晰程度,记录时间,用于判断碳酸氢钠晶体的产生速率。部分实验记录如下表所示:
序号 | 温度(℃) | 试管内经(mm) | CO2流速 (个气泡/s) | 产生不同现象的时间(s) | ||
字迹变浅 | 字迹模糊 | 字迹消失 | ||||
① | 25 | 10 | 5~8 | 517" | 719" | 817" |
② | 32 | 10 | 5~8 | 350" | 409" | 428" |
③ | 40 | 10 | 5~8 | 348" | 406" | 418" |
④ | 25 | 14 | 5~8 | 636" | 738" | 828" |
⑤ | 25 | 25 | 5~8 | X | 943" | 1022" |
⑥ | 25 | 10 | 10~13 | 502" | 640" | 758" |
⑦ | 25 | 10 | 2~5 | 540" | 1045" | 1236" |
(解释与结论)
(1)由上述溶解度曲线图可知溶解度受温度影响相对更大的物质是_________________。
(2)锥形瓶中是利用碳酸氢钠与稀硫酸反应来制取二氧化碳。除生成二氧化碳外,还有水和硫酸钠生成,该反应的化学方程式为_____________________。
(3) 同学们若要研究饱和碳酸钠溶液的体积对碳酸氢钠晶体产生速率是否有影响,需要控制的变量有__________________。
(4)由实验①②③,可得出的结论是____________________。
(5)实验①④⑤研究的影响因素是___________________。
(6)通过对数据的观察和分析,小倩认为“二氧化碳流速越快,碳酸氢钠晶体产生速率越快”,得到该结论的依据是______________(填实验序号)。
(反思与评价)
(7)表中X的取值范围应该是_______________。
(8)该实验采用硫酸而不是盐酸来制备二氧化碳的原因是__________________。
(9)如图中使用橡皮管连接分液漏斗与锥形瓶的目的是__________________。
(10)如何除去碳酸钠中混有的少量碳酸氢钠?___________________。
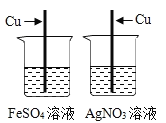
【题目】水是人类宝贵的自然资源。
(1)判断生活用水是硬水还是软水,可加入_________进行检验。
(2)下列净化水的单一操作中,相对净化程度较高的是_________(填字母)。
A 静置沉淀 B 吸附沉淀 C 蒸馏 D 过滤
(3)在电解水实验中,正负极产生的气体体积比约为_________。
(4)![]() 和
和![]() 在不同温度时的溶解度如下表所示。
在不同温度时的溶解度如下表所示。
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | |
溶解度/g |
| 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 | 169 |
| 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 | 4.55 | 48.3 | 51.1 | |
请回答下列问题:
①依据上表数据,绘制![]() 和
和![]() 的溶解度曲线,如图中能表示
的溶解度曲线,如图中能表示![]() 溶解度曲线的是__________(填“m”或“n”)。
溶解度曲线的是__________(填“m”或“n”)。

②由表中数据分析可知,![]() 和
和![]() 在某一温度时具有相同的溶解度x,则x的取值范围是__________。
在某一温度时具有相同的溶解度x,则x的取值范围是__________。
③现有40℃时等质量的硝酸钾、氯化钾饱和溶液,加热蒸发等质量的水后恢复至40℃,剩余溶液的质量关系大小为硝酸钾溶液__________氯化钾溶液(填“>”、“<”或“=”)。
A是80℃含有120g水的![]() 溶液,经过如下操作,得到102g
溶液,经过如下操作,得到102g![]() 固体。
固体。

下列对以上过程的分析,正确的是_________(填字母编号)
a A到B的过程中,溶质质量没有改变 b B中溶质与溶剂的质量比为169:100
c 开始析出![]() 固体的温度在60℃至70℃之间 d A溶液的质量等于222g
固体的温度在60℃至70℃之间 d A溶液的质量等于222g