题目内容
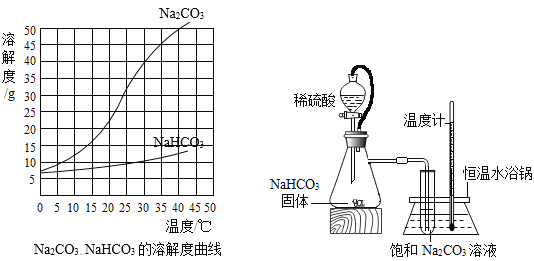
【题目】由于溶解度不同(如图所示),饱和碳酸钠溶液中通入CO 2会析出碳酸氢钠晶体而使溶液变浑浊。某化学课外小组同学发现不同条件下出现浑浊的时间不同。
(提出问题)影响碳酸氢钠晶体产生速率的因素有哪些?
(猜想与假设)碳酸氢钠晶体产生速率的影响因素有温度、试管内径、CO2流速、饱和碳酸钠溶液的体积。
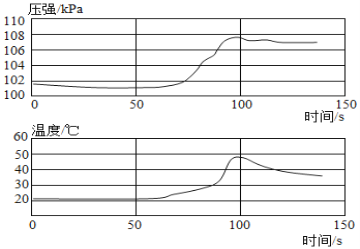
(进行实验)实验装置如图所示。每次实验时均在试管里加入1mL饱和碳酸钠溶液并在试管后放置一张写有黑色字迹的白纸,从垂直于试管的方向观察白纸上字迹的清晰程度,记录时间,用于判断碳酸氢钠晶体的产生速率。部分实验记录如下表所示:
序号 | 温度(℃) | 试管内经(mm) | CO2流速 (个气泡/s) | 产生不同现象的时间(s) | ||
字迹变浅 | 字迹模糊 | 字迹消失 | ||||
① | 25 | 10 | 5~8 | 517" | 719" | 817" |
② | 32 | 10 | 5~8 | 350" | 409" | 428" |
③ | 40 | 10 | 5~8 | 348" | 406" | 418" |
④ | 25 | 14 | 5~8 | 636" | 738" | 828" |
⑤ | 25 | 25 | 5~8 | X | 943" | 1022" |
⑥ | 25 | 10 | 10~13 | 502" | 640" | 758" |
⑦ | 25 | 10 | 2~5 | 540" | 1045" | 1236" |
(解释与结论)
(1)由上述溶解度曲线图可知溶解度受温度影响相对更大的物质是_________________。
(2)锥形瓶中是利用碳酸氢钠与稀硫酸反应来制取二氧化碳。除生成二氧化碳外,还有水和硫酸钠生成,该反应的化学方程式为_____________________。
(3) 同学们若要研究饱和碳酸钠溶液的体积对碳酸氢钠晶体产生速率是否有影响,需要控制的变量有__________________。
(4)由实验①②③,可得出的结论是____________________。
(5)实验①④⑤研究的影响因素是___________________。
(6)通过对数据的观察和分析,小倩认为“二氧化碳流速越快,碳酸氢钠晶体产生速率越快”,得到该结论的依据是______________(填实验序号)。
(反思与评价)
(7)表中X的取值范围应该是_______________。
(8)该实验采用硫酸而不是盐酸来制备二氧化碳的原因是__________________。
(9)如图中使用橡皮管连接分液漏斗与锥形瓶的目的是__________________。
(10)如何除去碳酸钠中混有的少量碳酸氢钠?___________________。
【答案】碳酸钠(Na2CO3) 2NaHCO3+H2SO4=2CO2![]() +2H2O+Na2SO4 试管内径、CO2流速、饱和碳酸钠溶液的体积 温度越高,晶体产生速率越快 试管内径 ①⑥⑦ 502"~636" 防止盐酸挥发出的氯化氢气体对反应造成的影响 保证装置内部压强保持不变,以免对反应产生影响 降温结晶
+2H2O+Na2SO4 试管内径、CO2流速、饱和碳酸钠溶液的体积 温度越高,晶体产生速率越快 试管内径 ①⑥⑦ 502"~636" 防止盐酸挥发出的氯化氢气体对反应造成的影响 保证装置内部压强保持不变,以免对反应产生影响 降温结晶
【解析】
[解释与结论]
(1)由上述溶解度曲线图可知溶解度受温度影响相对更大的物质是:碳酸钠(Na2CO3)。
(2)锥形瓶中是利用碳酸氢钠与稀硫酸反应来制取二氧化碳。除生成二氧化碳外,还有水和硫酸钠生成,该反应的化学方程式为:2NaHCO3+H2SO4=2CO2![]() +2H2O+Na2SO4。
+2H2O+Na2SO4。
(3)由表中数据可知,温度是变量,故同学们若要研究饱和碳酸钠溶液的体积对碳酸氢钠晶体产生速率是否有影响,需要控制的变量有:试管内径、CO2流速、饱和碳酸钠溶液的体积。
(4)由表中数据可知,温度是变量,由实验①②③,可得出的结论是:温度越高,晶体产生速率越快。
(5)由表中数据可知,试管内径是变量,故实验①④⑤研究的影响因素是:试管内径。
(6)通过对数据的观察和分析,小倩认为“二氧化碳流速越快,碳酸氢钠晶体产生速率越快”,得到该结论的依据是:①⑥⑦。
[反思与评价]
(7)由温度为25℃可知,X的取值最小为502",由CO2流速为5~8个气泡/s可知,X的最大值为636",故表中X的取值范围应该是502"~636"。
(8)由于盐酸有挥发性,故该实验采用硫酸而不是盐酸来制备二氧化碳的原因是:防止盐酸挥发出的氯化氢气体对反应造成的影响。
(9)如图中使用橡皮管连接分液漏斗与锥形瓶的目的是:保证装置内部压强保持不变,以免对反应产生影响。
(10)由图可知,碳酸钠的溶解度受温度的影响变化较大,碳酸氢钠的溶解度受温度的影响变化较小,且都随温度的升高而增大,故除去碳酸钠中混有的少量碳酸氢钠应采取降温结晶的方法。

【题目】化学与生活息息相关。
(1)食物的成分主要有蛋白质、糖类、油脂、 、无机盐和水等六大类,通常称为营养素。下列各类食物中含糖类最丰富的是 (填字母)。




A.蔬菜 | B.米饭 | C.鸡蛋 | D.牛奶 |
(2)世界卫生组织推广使用中国铁锅炒菜,放点食醋,可以补充人体需要的微量元素 元素。
(3)餐具上的油污用加入洗洁精的水更容易洗掉,原因是洗洁精具有 作用。
(4)泡打粉是一种化学膨松剂,主要是通过碳酸氢钠与一些酸性成分发生化学反应产生 气体而起到发泡作用。
(5)磨牙器能有效帮助去除牙齿表面的牙垢,磨牙器磨头采用50%橡胶与50%的金刚砂(主要成分为碳化硅)特制而成。已知碳化硅中碳元素-4价,硅元素+4价,则碳化硅的化学式为 。