题目内容
【题目】酸、碱、盐在生产和生活中有着广泛的应用。
(1)氢氧化钠溶液和氢氧化钙溶液都能使酚酞溶液变红,其原因是二者的溶液中均含有相同的粒子________(填粒子符号)。
(2)钠与水反应,生成一种碱和密度最小的气体,该反应的化学方程式为___________。
(3)向一定量的稀盐酸和氯化镁的混合溶液中,逐滴加入10%的氢氧化钠溶液至过量,并测得溶液的pH随加入氢氧化钠溶液质量的变化曲线如图所示。
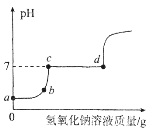
①b点溶液中含有哪些溶质__________________?(写化学式)
②写出c→d段反应的化学方程式__________________。
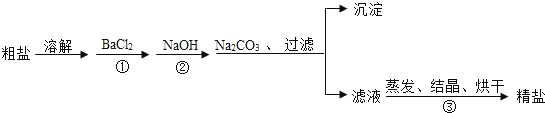
(4)某同学为了除去食盐水中的MgCl2、CaCl2、Na2SO4等杂质,设计了如图所示的实验方案。
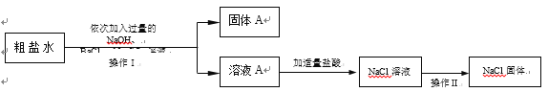
①操作II中玻璃棒的作用是___________?
②加入过量Na2CO3溶液的作用是____________________。
③写出该实验过程中发生的中和反应的化学方程式__________。
(5)为测定某石灰石样品中碳酸钙的质量分数,称取10 g石灰石(杂质不参加反应)放入烧杯中,加入100 g稀盐酸,二者恰好完全反应,反应后烧杯中剩余物质的总质量为106.7 g(气体的溶解忽略不计)。请计算该样品中碳酸钙的质量分数__________。
【答案】OH- 2Na+2H2O=2NaOH+H2↑ HCl、NaCl、MgCl2 2NaOH+MgCl2=2NaCl+Mg(OH)2↓ 搅拌,防止局部温度过高造成液滴飞溅 除去氯化钙和过量的氯化钡 HCl+NaOH=NaCl+H2O 75%
【解析】
(1)因氢氧化钠溶液和氢氧化钙溶液中都含有相同的氢氧根离子,则它们都能使无色的酚酞试液变红,故答案为:OH-.
(2)钠和水反应生成氢氧化钠和氢气,化学方程式为:2Na+2H2O=2NaOH+H2↑,故填:2Na+2H2O=2NaOH+H2↑。
(3)①向一定量的稀盐酸和氯化镁混合溶液中,逐滴加入氢氧化钠溶液至过量,盐酸会先与氢氧化钠反应生成氯化钠和水,然后氯化镁再与氢氧化钠反应生成氢氧化镁沉淀和氯化钠,b点溶液PH小于7,说明盐酸还有剩余,b点溶液中含有的盐酸、氯化钠和氯化镁;故填:HCl、NaCl、MgCl2。
②c→d段溶液的PH不变,原因是氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,化学方程式为:2NaOH+MgCl2=2NaCl+Mg(OH)2↓;故填:2NaOH+MgCl2=2NaCl+Mg(OH)2↓。
(4)①操作II是蒸发,玻璃棒的作用是搅拌,防止局部温度过高造成液滴飞溅;故填:搅拌,防止局部温度过高造成液滴飞溅;
②碳酸钠能和氯化钙反应生成碳酸钙沉淀和氯化钠,能和过量的氯化钡反应生成碳酸钡沉淀和氯化钠;故填:除去氯化钙和过量的氯化钡;
③写出该实验过程中发生的中和反应是盐酸和过量的氢氧化钠反应生成氯化钠和水,化学方程式为HCl+NaOH=NaCl+H2O。故填:HCl+NaOH=NaCl+H2O。
(5)生成二氧化碳的质量为:10g+100g-106.7g=3.3g
设生成3.3g二氧化碳需要碳酸钙的质量为y

y=7.5g
该样品中碳酸钙的质量分数为:![]() ×100%=75%
×100%=75%
答:该样品中碳酸钙的质量分数为75%。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案