题目内容
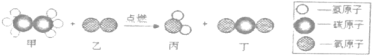
【题目】已知M、N在一定条件下,能发生反应:M+2N=P+2Q,则下列说法中不正确的是( )
A. 若M、N、P、Q都是由分子构成的物质,则该反应前后分子的数目一定不变
B. M、N、P、Q可能含有同一种元素
C. 若P、Q是盐和水,则M、N必有一种物质是酸
D. 若16gM 和64gN能恰好完全反应,则M、N的相对分子质量之比为1:2
【答案】C
【解析】
A、若M、N、P、Q都是由分子构成的物质,由反应的化学方程式M+2N=P+2Q可知,该反应前后分子的数目一定不变,故A正确;
B、M、N、P、Q有可能含有同一种元素,如氢氧化钠和硫酸反应生成硫酸钠和水,反应物和生成物中均含有氧元素,故B正确;
C、若P、Q是盐和水,则M、N不一定必有一种物质是酸,如CO2+Ca(OH)2═CaCO3↓+H2O,故C错误;
D、设M、N的相对分子质量分别为x、y,由反应的化学方程式,![]() ,x:y=1:2,故D 正确,故选C。
,x:y=1:2,故D 正确,故选C。

【题目】探究实验展示了化学的无穷魅力.我们在实验的过程中也提炼了许多探究方法.
(提出问题)小松想探究分子的运动速率与相对分子质量的关系.
(假设猜想)
①相对分子质量越大,分子运动速率越快.
②_____
(查阅资料)已知浓氨水能挥发出氨气,浓盐酸能挥发出氯化氢气体,二者接触反应会产生白烟(氯化铵固体)
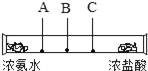
(设计实验)如图所示,在玻璃管两端分别放入蘸有浓氨水和浓盐酸的棉花团.
(实验现象)C处产生的白烟较多.
(解释与结论)氨分子的分子质量(相对分子质量)_____(填“大于”、“等于”或“小于”)氯化氢分子的分子质量(相对分子质量),由此可知,分子质量(相对分子质量)越_____(填“大”或“小”),分子的速率越_____(填“快”或“慢”).
(拓展探究)小松在完成上述实验后,还想研究分子运动速率与温度的关系.
他将等量的品红分别滴入到等量的热水和冷水中,其实验现象如下所示.
实验过程 | 冷水 | 热水 |
开始 | 红色扩散较慢 | 红色扩散较快 |
长久放置 | 最终均成为红色、均匀、透明的液体 | |
依据此实验现象,得出的结论是_____.