题目内容
【题目】酸、碱、盐是我们身边重要的化合物,在生活和生产中具有广泛的应用。
(1)某锅炉水垢的主要成分有CaCO3、Mg(OH)2、Fe2O3,用“酸洗”法可除去该水垢。但“酸洗”时,一般不选用稀硫酸的原因是_______________。
(2)春秋末期齐国的工艺官书《考工记》中载有“涑帛”的方法,即利用“灰”(草木灰:K2CO3)和“蜃”(贝壳灰:CaO)混合加水所得溶液来洗涤帛,这种溶液能洗涤丝帛是因为其中一定含有的物质是______________(水除外)。
(3)两种抗胃酸药剂的主要成分及建议每次剂量见下表:
主要成分 | NaHCO3 | Mg(OH)2 |
建议每次剂量/g | 0.5 | 0.3 |
①服用Mg(OH)2的药效比服用NaHCO3“强”的原因是_______________。
②写出NaHCO3与胃酸主要成分反应的化学方程式:________________。
【答案】硫酸与碳酸钙反应生成CaSO4微溶于水,覆盖在水垢表面,难以除尽 KOH ①等质量的Mg(OH)2消耗的盐酸比NaHCO3多 NaHCO3+HCl=NaCl+H2O+CO2↑
【解析】
(1)水垢的主要成分有CaCO3与硫酸反应生成硫酸钙,硫酸钙是微溶于水,覆盖在水垢表面,阻碍反应,难以除尽水垢。
(2)氧化钙和水反应生成氢氧化钙,氢氧化钙再与碳酸钾反应生成碳酸钙沉淀和氢氧化钾,其中氢氧化钾溶液呈碱性,性质与氢氧化钠相似,可以用于作洗涤剂。
(3)①Mg(OH)2与胃酸反应的化学方程式为![]() ,根据该方程式可算出参加反应的氢氧化镁和盐酸的质量比为58:73;NaHCO3与胃酸反应的方程式为
,根据该方程式可算出参加反应的氢氧化镁和盐酸的质量比为58:73;NaHCO3与胃酸反应的方程式为![]() ,根据该方程式可算出参加反应的碳酸氢钠和盐酸的质量比为84:36.5=168:73;从它们的质量比可知,消耗相同质量的盐酸,碳酸氢钠用量大,氢氧化镁用量少,故服用Mg(OH)2的药效比服用NaHCO3“强”。
,根据该方程式可算出参加反应的碳酸氢钠和盐酸的质量比为84:36.5=168:73;从它们的质量比可知,消耗相同质量的盐酸,碳酸氢钠用量大,氢氧化镁用量少,故服用Mg(OH)2的药效比服用NaHCO3“强”。
②胃酸主要成分为盐酸,与NaHCO3反应的化学方程式为NaHCO3+HCl=NaCl+H2O+CO2↑。

【题目】请从A或B两题中任选一个作答,若两题均作答,按A计分。
A | B |
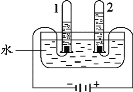
(1)电解水实验揭示了水的组成。下图实验中得到氧气的试管是_______(填“1”或“2”)。 (2)电解水的化学方程式为_________。
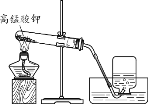
| (1)潜水时需要氧气,说明氧气能________。 (2)用高锰酸钾制取氧气的化学方程式为_________。
|