题目内容
取碳酸钠和氯化钠的固体13.6 g与质量为73 g的稀盐酸恰好完全反应,产生4.4g二氧化碳。计算:(可能用到的相对原子质量:C-12 O-16 Na-23.5 Cl-35.5)
(1)固体混合物中氯化钠的质量;
(2)该稀盐酸中氯化氢的质量分数。
(1)固体混合物中氯化钠的质量;
(2)该稀盐酸中氯化氢的质量分数。
解:设混合物中碳酸钠质量为X,消耗的稀盐酸质量为Y,则有
Na2CO3 + 2HCl =" 2NaCl+ " CO2↑+ H2O 2分
106 73 44
X Y 4.4 g 2分
解之得:X="10.6" g 1分
Y=" 7.3" g 1分
m(NaCl)=13.6g-10.6 g = 3g 1分
w(HCl)=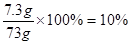 1分
1分
答:略
(以上各问合理答案均给分)
Na2CO3 + 2HCl =" 2NaCl+ " CO2↑+ H2O 2分
106 73 44
X Y 4.4 g 2分
解之得:X="10.6" g 1分
Y=" 7.3" g 1分
m(NaCl)=13.6g-10.6 g = 3g 1分
w(HCl)=
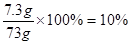 1分
1分答:略
(以上各问合理答案均给分)
略

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
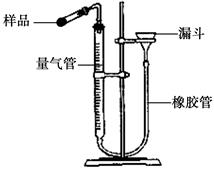
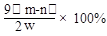 。此方案测定结果偏小的原因可能是 。
。此方案测定结果偏小的原因可能是 。