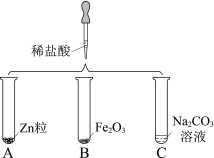
题目内容
【题目】某厂电镀液废水中含有硫酸和硫酸铜两种溶质为测定其中各成分的含量,69 中化学实验小组的同学们取 100g 废水样品,在实验室中利用溶质质量分数为 20% 的 NaOH 溶液进行测定,所得到的相关数据如图所示。请回答下列问题:
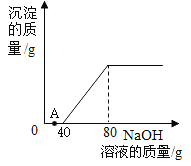
(1)A 点发生反应的化学方程式为______________;
(2)根据已知条件,列出求解反应生成沉淀的质量(x)的比例式为________________;
(3)A 点溶液中含有的离子是_________________(填离子符号) ;
(4)当加入 80g 氢氧化钠溶液充分反应后过滤出沉淀,将溶液蒸发掉 28.2g 水,所得到的不饱和溶液中溶质的质量分数为______________;
(5)若想把 100kg 这样的废液转化为纯净的硫酸铜溶液,需要加入含杂质 20%的氧化铜(杂质不溶于水,也不与酸反应)的质量为______________。再经过一系列操作,就可以得到纯净的硫酸铜溶液。
【答案】![]()
![]() H+、SO42-、Na+ 20% 10kg
H+、SO42-、Na+ 20% 10kg
【解析】
(1)向废水样品中加入氢氧化钠溶液,氢氧化钠先与硫酸反应生成硫酸钠和水,待硫酸完全反应后,氢氧化钠再与硫酸铜反应生成氢氧化铜和硫酸钠,由图可知,A点时,无沉淀产生,故是氢氧化钠与硫酸反应生成了硫酸钠和水,该反应的化学方程式为:![]() ;
;
(2)由图可知,加入氢氧化钠溶液的质量为80g时,沉淀质量不再变化,故这时,氢氧化钠与硫酸铜恰好完全反应,硫酸铜消耗氢氧化钠的质量为:(80g-40g)×20%=8g;
解:设生成沉淀的质量为x,反应生成硫酸钠的质量为y
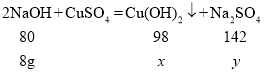
![]() x=9.8g
x=9.8g
![]() y=14.2g
y=14.2g
答:求解反应生成沉淀的质量(x)的比例式为:![]() ;
;
(3)氢氧化钠与硫酸反应生成硫酸钠和水,A点时,硫酸未完全反应,故A 点溶液中含有的离子是:H+、SO42-、Na+;
(4)解:设氢氧化钠与硫酸反应生成硫酸钠的质量为z,废水中硫酸的质量分数为m

![]() z=14.2g
z=14.2g
![]() m=9.8%
m=9.8%
所得到的不饱和溶液中溶质的质量分数为:![]() ;
;
(5)解:设需要含杂质20%的氧化铜的质量为n

![]() n=10kg
n=10kg
答:需要含杂质20%的氧化铜的质量为10kg。

【题目】2019 年12月以来,部分地区突发的新型冠状病毒肺炎威胁着人们的身体健康。预防病毒除了戴口罩、勤洗手,还要做好消毒工作。市面上可以有效消灭新型冠状病毒的消毒剂如下图所示:
医用酒精: 75%的乙醇溶液,
84消毒液: >0.05%的次氯酸钠溶液等,
医用消毒液:过氧化氢过氧乙酸消毒液
衣服消毒液: >0.12%的对氯间二甲苯酚
季铵盐溶液:>0.2%季铵盐溶液
请按要求填空:
①将部分消毒剂中的主要成分进行分类(选填“有机物、酸、碱、盐、氧化物”)
物质 | 酒精 | 次氯酸钠(NaClO) | 过氧化氢 |
物质类别 | ___ | ___ | ___ |
②使用医用酒精进行消毒时,要远离明火,这是因为酒精具有___的化学性质。
③公共场合可用0.5%的过氧乙酸(化学式为C2H4O3)溶液进行消毒。过氧乙酸的摩尔质量为______, 1摩尔过氧乙酸中碳原子的个数为_______个(用科学计数法)。若要配制这样的溶液1000克,需要过氧乙酸___克。
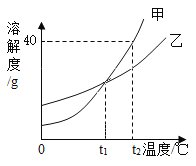
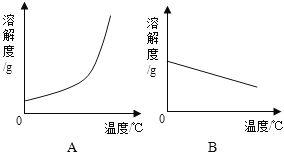
【题目】下表是Ca(OH)2和NaOH的溶解度数据。请回答下列问题:
温度/°C | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/(g/100g水) | Ca(OH)2 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 |
NaOH | 31 | 91 | 111 | 129 | 313 | 336 | |
①依据上表数据,绘制Ca(OH)2和NaOH的溶解度曲线,下图中表示NaOH溶解度曲线的是_____(填A或B)。
②把一瓶接近饱和的Ca(OH)2溶液变成饱和溶液,具体措施有_____。(填一种)
③20℃时,191g饱和NaOH溶液,恒温蒸发10g水后,可析出NaOH晶体_____g。
④现有60°C时含Ca(OH)2和NaOH两种溶质的饱和溶液,若要得到较纯净的NaOH晶体,应采取的物理方法是_____。
⑤20℃时,欲测定NaOH溶液的pH,若先将pH试纸用蒸馏水润湿,再进行测定,则所测溶液的pH_____(填“偏大”、“偏小”或“不受影响”)。