题目内容
【题目】用辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)制备难溶于水的碱式碳酸铜的流程如下:
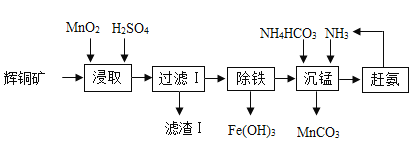
(1)请写出碱式碳酸铜的化学式_____
(2)滤渣l中有什么_____
(3)过滤用到到仪器有那些_____
(4)除铁的化学方程式是什么_____
(5)图中能重复利用的物质有那些_____
【答案】Cu2(OH)2CO3 MnO2、S和SiO2 烧杯、漏斗、铁架台、玻璃棒 3Cu(OH)2+Fe2(SO4)3=2Fe(OH)3↓+3CuSO4 NH3
【解析】
(1)由流程图可知,最后得到的产物为碱式碳酸铜,其化学式为Cu2(OH)2CO3。
(2)辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质),向其加入二氧化锰、硫酸浸取,氧化铁和硫酸反应生成硫酸铁和水,二氧化锰、硫化铜和稀硫酸反应生成硫单质、硫酸铜、硫酸锰、和水,反应的化学方程式是:2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O;二氧化硅不和硫酸反应。故经过过滤得到的滤渣1中含有硫、二氧化硅和过量的二氧化锰。
(3)在过滤操作时,需要用到的仪器为烧杯、漏斗、铁架台、玻璃棒。
(4)“除铁”的方法是通过调节溶液pH,使硫酸铁中的Fe3+水解转化为Fe(OH)3,加入的试剂A应用于调节溶液pH,促进铁离子的水解,但不能引入杂质,因最后要制备碱式碳酸铜,则可加入氢氧化铜,氢氧化铁的溶解度小于氢氧化铜,氢氧化铜和硫酸铁反应生成氢氧化铁沉淀和硫酸铜,反应方程式为3Cu(OH)2+Fe2(SO4)3=2Fe(OH)3↓+3CuSO4。
(5)由于过程中开始投入氨气作为反应物,后期又生成了氨气,所以氨气在过程中可以循环使用,化学式为 NH3。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】我国是以煤为主要燃料的大国,北京的雾霾天气与煤作为燃料有关。煤燃烧生成的SO2是酸雨的主要污染物。
(1)工业上常以生石灰(CaO)为脱硫剂,高温下与废气中的SO2、O2化合生成CaSO4,反应方程式为________________________。
(2)某同学利用中和反应的原理模拟脱硫,将SO2通入足量KOH溶液中,并探究反应后溶液中溶质的成分。
(资料)①亚硫酸盐能使酸性KMnO4溶液褪色;②常温下,硝酸能把亚硫酸及亚硫酸盐氧化成硫酸和硫酸盐;③亚硫酸与碳酸相似,在常温下易分解。
(猜想)(Ⅰ)K2SO3;(Ⅱ)K2SO4;(Ⅲ)________________。
(进行试验)
步骤 | 实验操作 | 实验现象 | 结论 |
① | 取一定量反应后的溶液于A、B两只试管中 | ||
② | 向A试管中滴入几滴酸性KMnO4溶液。 | ________。 | 证明有K2SO3。 |
③ | 向B试管中滴入足量的稀盐酸,再加入_______。 | 有白色沉淀生成 | 证明有________。 |
(作出判断)猜想________成立。
(拓展)实验③沉淀产生的反应方程式是________________________________________。