题目内容
【题目】现有盐酸和氯化铜的混合溶液,向其中逐滴滴入氢氧化钠溶液,生成沉淀质量与滴入氢氧化钠溶液质量的变化关系如图所示。以下说法正确的是
①滴加氢氧化钠的质量至a g时,溶液中含有三种溶质
②滴加氢氧化钠溶液的质量为m(b g< m < c g),此时溶液中发生的化学反应为CuCl2+2NaOH= Cu(OH)2↓+2NaCl
③滴加氢氧化钠溶液的质量至d g时,溶液pH>7
④在滴加氢氧化钠溶液的整个过程中,溶液中氯离子的数目先减小后不变
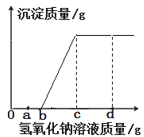
A.②③B.③④C.①②③D.②③④
【答案】C
【解析】
向其中逐滴滴入氢氧化钠溶液,氢氧化钠先和盐酸反应生成氯化钠和水,后和氯化铜反应生成蓝色沉淀氢氧化铜和氯化钠。
①滴加氢氧化钠溶液的质量至ag时,氢氧化钠先和盐酸反应生成氯化钠和水,且此时稀盐酸还未反应完,溶液中含有三种溶质,即没有反应的氯化铜、剩余的氯化氢和反应生成的氯化钠;
②滴加氢氧化钠溶液的质量为m(bg<m<cg),此时溶液中发生的化学反应为CuCl2+2NaOH═Cu(OH)2↓+2NaCl;
③滴加氢氧化钠溶液的质量至dg时,氢氧化钠溶液过量,溶液pH>7;
④在滴加氢氧化钠溶液的整个过程中,溶液中氯元素的质量始终不变。其中正确的有①②③。故选C。

 春雨教育同步作文系列答案
春雨教育同步作文系列答案【题目】为了测定实验中氯酸钾样品的纯度,某兴趣小组取2.5克样品与0.8克二氧化锰混合。加热该混合物t1时间后(假设杂质不参加反应),冷却,称量剩余固体质量,重复以下操作,依次称得加热t1、t2、 t3、t4时间后剩余固体的质量,记录数据如表:
加热时间 | t1 | t2 | t3 | t4 |
剩余固体质量/g | 2.48 | 2.41 | 2.34 | 2.34 |
请仔细分析实验数据,回答下列问题:
(1)在多长时间后,该样品中的氯酸钾已经反应完全。
(2)计算完全反应后生成氧气的质量为多少。
(3)求该样品中氯酸钾的质量分数。