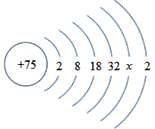
题目内容
【题目】元素周期表是学习和研究化学的重要工具,下表是原子序数为1—18 号元素的原子结构示意图。
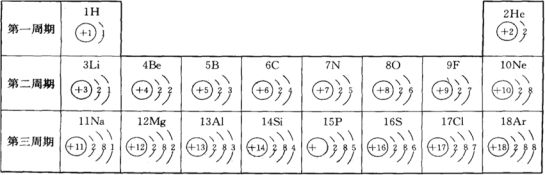
(1)原子序数为12 的元素名称为___________,其原子核外有___________个电子层, 化学反应中易______(填得到、失去)电子,形成_______________(填阴离子或阳离子)。
(2)根据上图总结出:原子序数等于原子的核电荷数,你还能找出哪些规律,至 少写3 条:
①________________________________
②________________________________
③_______________________________
(3)溴(Br)原子结构示意图为 应位于第_________周期。性质与上表中第二周期______元素化学性质相似。
应位于第_________周期。性质与上表中第二周期______元素化学性质相似。
【答案】镁 3 失去 阳离子 同一周期中,电子层数相同,最外层电子数依次递增 同一族中,最外层电子数相同 核内质子数等于核外电子数 四 氟
【解析】
本题考查元素周期表中元素的规律。
(1)由元素周期表,可以知道原子序数为12的元素名称为镁元素,故答案为:镁;
(2)由元素周期表可知,镁原子核外有3个电子层,故答案为:3;
(3)镁的最外层电子为2,少于4个,易“失去”2个电子形成阳离子,故答案为:失去;
(4)由(3)可知,失电子形成的是阳离子,故答案为:阳离子;
(5)从表中发现如下规律:同一周期中,电子层数相同,最外层电子数依次递增,故答案为:同一周期中,电子层数相同,最外层电子数依次递增;
(6)从元素周期表中还可发现如下规律:同一族中,最外层电子数相同,故答案为:同一族中,最外层电子数相同;
(7)从原子结构示意图可知,核内质子数等于核外电子数,故答案为:核内质子数等于核外电子数;
(8)周期数等于电子层数,所以溴(Br)原子应位于第四周期,故答案为:四;
(9)溴元素最外层电子数与第二周期氟元素相同,都为7,所以它们的化学性质相似,故答案为:氟。

【题目】如图为实验室常用的制取气体装置:
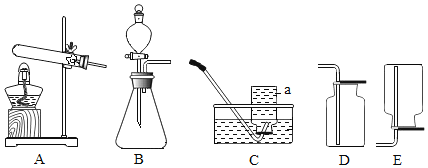
(1)仪器a的名称是______;组装A装置时,酒精灯应在固定试管之______(填“前”或“后”)放置.
(2)实验室用高锰酸钾制取氧气,反应的化学方程式:______,宜选用的发生装置是______(填装置标号,下同),不宜选用的收集装置是______.
(3)实验室制取二氧化碳的研究中,在其他条件相同的情况下,进行如下实验:
实验标号 药品 | 甲 | 乙 | 丙 | 丁 |
大理石(mg) | 块状 | 块状 | 粉末状 | 粉末状 |
盐酸(过量) | 稀盐酸 | 浓盐酸 | 稀盐酸 | 浓盐酸 |
①实验室制取二氧化碳的化学方程式:______.
②若要研究盐酸浓度大小对反应快慢的影响,可选择实验甲与______(填实验编号)对照.
③除盐酸的浓度外,上述实验研究的另一个影响反应快慢的因素是______.
④研究发现盐酸的浓度越大,产生气体越快.与甲比较,下列对丁分析正确的是______(填标号)
A.反应更剧烈 B.产生的二氧化碳的质量更大 C.参加反应的大理石更多
(4)请从实验原理、原料、发生装置、操作等方面,阐述下列实验中可以产生较平稳气体的主要原因.
实验目的 | 原料 | 发生装置 | 主要原因 |
制取氧气 | 粉末状二氧化锰和稀过氧化氢溶液 | B | ______ |