题目内容
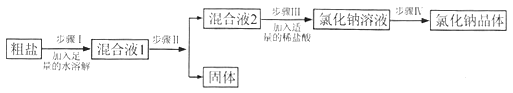
【题目】某实验小组利用图1所给仪器配制一定溶质质量分数的氯化钠溶液。
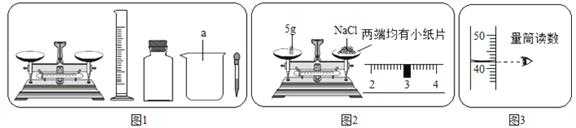
(1)图1中缺少一种必须用到的玻璃仪器是_________。
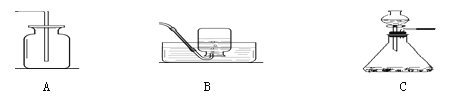
(2)图2中的操作错误是______________,若按图2操作,称量的氯化钠的实际质量是______。
(3)量取蒸馏水的体积读数如图3所示,则该实验小组原计划配制的氯化钠溶液的溶质质量分数为(水的密度为1/cm3)_____________ 。
(4)该实验小组按照上述操作完成实验,则配制溶液的实际溶质质量分数是____________。(保留一位小数)
【答案】 玻璃棒 氯化钠和砝码位置放反了 12g 18% 12.8%
【解析】(1)该图表示配制溶液全过程需用的所用仪器,称量使用托盘天平、量筒,溶解时还会用到烧杯和玻璃棒;
(2)由图示可以看出托盘天平的使用错误,物码放反了,由正确称量:“物质质量=砝码质量=游码质量”得出:药品实际质量=砝码质量-游码质量=15g-3g=12g;
(3)由图示中所示数据可得,每小格所表示的质量为1mL,水的体积为82mL,再由水的密度1g/mL,由公式m=ρV得出水的质量为:82mL×1g/mL=82g,由托盘天平中砝码与游码的质量可知,该实验欲称药品质量为:10g+5g+3g=18g,溶液质量为:82g+18g=100g,由溶质质量分数的计算公式得溶质质量分数为:![]() ×100%=18%;
×100%=18%;
(4)实际配制的溶液中溶质的质量为12g,取用的水的质量为82mL合82g,所配制的溶液的溶质质量分数为![]() ×100%≈12.8%。
×100%≈12.8%。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目