题目内容
【题目】根据化学式的计算,是所有化学计算的基础,包含了相对分子质量(Mr)、元素质量比、元素质量分数等方面,其计算原理如下:
Ⅰ、相对分子质量计算:化学式中各元素的相对原子质量之和,如:(注:相对原子质量:C—12;O—16,下同)CO2:Mr=12+16×2=12+32=44。
Ⅱ、纯净物中各元素的质量比:化学式中各元素的相对原子质量之和的比值,如:CO2:碳、氧元素的质量比:C∶O=12∶(16×2)=12∶32=3∶8。
Ⅲ、纯净物中某元素的质量分数:化学式中某元素的相对原子质量之和占相对分子质量的百分比,如:CO2:氧元素的质量分数:![]()
![]()
![]() 。
。
结合上述信息,根据化学式:Fe2O3;请计算:(相对原子质量:Fe—56;O—16)
(1)计算Fe2O3的相对分子质量(Mr):_____;
(2)计算Fe2O3,铁、氧元素的质量比:_____;
(3)计算Fe2O3,铁元素的质量分数:_____;
(4)160gFe2O3含有铁元素的质量为_____g。
【答案】160 7:3 70% 112g
【解析】
(1)Fe2O3的相对分子质量(Mr)为![]() ;
;
(2)Fe2O3,铁、氧元素的质量比![]() ;
;
(3)Fe2O3,铁元素的质量分数为![]() ;
;
(4)160gFe2O3含有铁元素的质量为![]() 。
。

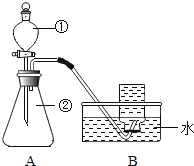
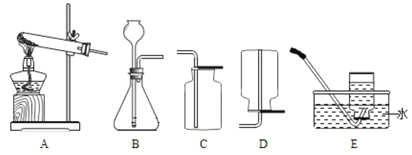
【题目】实验探究:课本第二单元课后作业中有“寻找新的催化剂” 的探究内容,实验中学探究小组据此设计了如下探究方案。
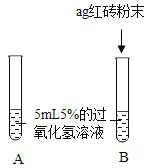
(提出问题)红砖粉末能否作为过氧化氢溶液分解的催化剂?如果能,效果如何?
(实验探究)
实验步骤 | 实验现象 | 实验结论及解释 |
Ⅰ. | A中无明显现象, B中产生大量能使带火星木条复燃的气体 | ①产生的气体是_____ ②红砖粉末能改变过氧化氢分解速率 |
Ⅱ. 向B试管中重新加入5%的过氧化氢溶液,反应停止后过滤、洗涤、干燥、称量滤渣 | ①又产生大量能使带火星木条复燃的气体 ②滤渣质量等于ag | 红砖粉末的_____在反应前后均没有发生变化, 能作过氧化氢分解的催化剂 |
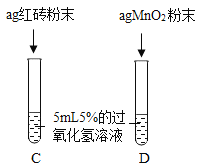
Ⅲ. | 两试管中均产生气泡且_____ | 红砖粉末的催化效果没有二氧化锰粉末好 |