题目内容
【题目】研究小组准备用多种方法制备氧气。
(方法一)用过氧化氢溶液和二氧化锰制取氧气,反应的化学方程式是_______________________
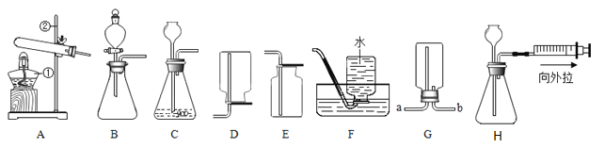
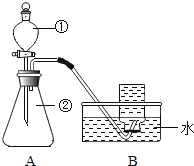
搭建如图实验装置,写出编号仪器名称。A_____________________ B___________________
实验前,先在锥形瓶中加入____________,在分液漏斗中加入3%左右的过氧化氢溶液。实验时,打开分液漏斗的活塞,向锥形瓶中加入过氧化氢溶液。此时观察到的现象是__________________,为使反应平稳进行,应进行的实验操作是____________________。用图示方法收集氧气是因为______________,当观察到导管口出现_____________________________时,开始收集。实验完毕后,若未将导管移出水槽,水____________________(填“会”或“不会”)倒吸入锥形瓶。
(方法二)加热氯酸钾和二氧化锰混合物制氧气。
小资料:高锰酸钾(KMnO4)加热分解也能产生氧气,同时生成锰酸钾(K2MnO4)和二氧化锰,且锰酸钾常温下呈固态。
甲同学只加热2.45g氯酸钾,完全分解生成a摩尔氧气,试计算a的值。___________________(化学方程式计算);乙同学误将少量高锰酸钾(KMnO4)当作二氧化锰放入2.45g氯酸钾内混合加热,完全反应后生成氧气的物质的量___________________(填“大于”、“小于”或“等于”)a摩尔。实验过程中,甲、乙两同学中产生氧气速率较快的是____________(填“甲”或“乙”),原因是__________________________________。
【答案】2H2O2![]() 2H2O + O2↑ 集气瓶 水槽 MnO2 有气泡的产生 调节分液漏斗的活塞 氧气不易溶于水,且不与水反应 连续均匀的气泡 不会 0.03 大于 乙 高锰酸钾的分解产物中有二氧化锰,可以作为催化剂
2H2O + O2↑ 集气瓶 水槽 MnO2 有气泡的产生 调节分液漏斗的活塞 氧气不易溶于水,且不与水反应 连续均匀的气泡 不会 0.03 大于 乙 高锰酸钾的分解产物中有二氧化锰,可以作为催化剂
【解析】
过氧化氢在二氧化锰作催化剂的条件下反应生成水和氧气,故反应的化学方程式写为:2H2O2![]() 2H2O + O2↑;
2H2O + O2↑;
仪器①的名称是分液漏斗,故填分液漏斗;
仪器②的名称是锥形瓶,故填锥形瓶;
向装置中加入药品时,应先加固体,再加液态,故填二氧化锰(或MnO2);
过氧化氢分解生成氧气,在溶液中产生气泡,故填有气泡的产生;在固液常温气体发生装置中,可以通过调节分液漏斗的活塞来控制滴加液体的量进而控制反应速率,故填调节分液漏斗的活塞;
图示方法为排水法收集气体,该方法适用于收集不易溶于水,且不与水反应的气体,故填氧气不易溶于水,且不与水反应;
用排水法收集气体时,当导管口有气泡连续均匀出现时开始收集气体,故填连续均匀的气泡;
该反应在常温条件下发生的,不会出现气体热胀冷缩的现象,且反应后发生装置内外压强差距不大,不会产生水倒吸的现象,故填不会。
方法二:
解:设生成氧气的质量为x
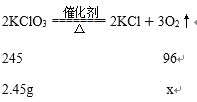
245:96 = 2.45g:x
X=0.96g
生成氧气的物质的量为:0.96g÷32g/mol=0.03mol,故填0.03;
高锰酸钾分解也能生成氧气,所以反应后生成氧气的物质的量大于a摩尔,故填大于;
乙同学的反应中加入了高锰酸钾反应速率会加快,故填乙;
高锰酸钾分解后生成二氧化锰,二氧化锰作催化剂能加快氯酸钾分解的速率,故填高锰酸钾的分解产物中有二氧化锰,可以作为催化剂。

 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案