题目内容
根据蔗糖的化学式(C12H22O11)回答:
(1)蔗糖中有________ 种元素,原子个数比________,相对分子质量为________.
(2)氢元素的质量分数为________.
(3)171g蔗糖中有________ 克碳元素.
解:蔗糖的化学式是C12H22O11,宏观意义是:蔗糖由三种元素组成,微观意义是:碳、氢、氧的原子个数比为:12:22:11;相对分子质量=12×12+1×22+16×11=342;氢元素的质量分数= ×100%=6.4%;171g×
×100%=6.4%;171g×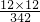 ×100%=72g,故答案为:①3;12:22:11; 342 ②6.4% ③72
×100%=72g,故答案为:①3;12:22:11; 342 ②6.4% ③72
分析:根据蔗糖的化学式:C12H22O11,可以看出蔗糖由三种元素组成,其中碳、氢、氧的原子个数比为:12:22:11;还可以计算相对分子质量;计算某一元素的质量分数;也可以由整体的质量,求某一元素的质量.
点评:本考点考查了有关化学式的计算和化学式表示的意义,解此类题时,只要根据化学式中原子的个数和相对原子质量进行计算,问题就会迎刃而解.本考点主要出现在填空题和计算题中.
 ×100%=6.4%;171g×
×100%=6.4%;171g×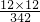 ×100%=72g,故答案为:①3;12:22:11; 342 ②6.4% ③72
×100%=72g,故答案为:①3;12:22:11; 342 ②6.4% ③72分析:根据蔗糖的化学式:C12H22O11,可以看出蔗糖由三种元素组成,其中碳、氢、氧的原子个数比为:12:22:11;还可以计算相对分子质量;计算某一元素的质量分数;也可以由整体的质量,求某一元素的质量.
点评:本考点考查了有关化学式的计算和化学式表示的意义,解此类题时,只要根据化学式中原子的个数和相对原子质量进行计算,问题就会迎刃而解.本考点主要出现在填空题和计算题中.

练习册系列答案
相关题目
 柠檬酸为无色半透明晶体,无臭、味极酸,易溶于水和乙醇,在潮湿空气中易潮解.
柠檬酸为无色半透明晶体,无臭、味极酸,易溶于水和乙醇,在潮湿空气中易潮解.

 用微粒的观点看世界,认识物质构成的奥秘,正确书写常见的化学符号是学习化学的基础.
用微粒的观点看世界,认识物质构成的奥秘,正确书写常见的化学符号是学习化学的基础.

