题目内容
 柠檬酸为无色半透明晶体,无臭、味极酸,易溶于水和乙醇,在潮湿空气中易潮解.
柠檬酸为无色半透明晶体,无臭、味极酸,易溶于水和乙醇,在潮湿空气中易潮解.(1)上述划线部分属于柠檬酸的
(2)柠檬酸(C6H8O7)在氧气中完全燃烧的化学方程式:
(3)工业上柠檬酸由蔗糖发酵制得,发生的主要反应为:C12H22O11+3
(4)食品加工业中,可以用压制柑橘所得汁液作为提取柠檬酸的原料.提取过程如下:
①原料提取:柑橘汁液中有不少果胶及固体杂质,需进行初步提纯,自然沉降后用压滤机进行
②中和:在①所得原料澄清液中加入石灰浆,…,至溶液呈青绿色时,即表示已完成中和反应.然后静置沉淀,此沉淀即为果酸钙(以柠檬酸钙为主). 若用H3R表示柠檬酸的化学式,请书写该中和反应的化学方程式
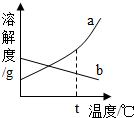
③除盐:所得柠檬酸钙中含有某种盐分,可用70~80℃热水洗涤,反复多次,直至盐分除净为止.请根据操作分析该盐分的溶解度曲线可能是图中
④酸解脱色:柠檬酸钙浆液与浓度为35%的硫酸充分反应,静置沉淀,上层清液为柠檬酸溶液,此反应属于
⑤浓缩结晶:将不饱和柠檬酸液进行恒温浓缩结晶.在此过程中,保持不变的是
a.溶液中溶剂的质量 b.柠檬酸的溶解度
c.溶液中溶质的质量分数 d.溶液和晶体中柠檬酸总质量.
分析:(1)根据化学性质的概念(物质在化学变化中所表现出来的性质)回答;
(2)根据质量守恒定律来书写;
(3)根据质量守恒定律反应前后原子个数相等来回答;
(4)①根据过滤的原理、方法回答;②根据酸碱中和反应的原理③根据“用70~80℃热水洗涤,反复多次,直至盐分除净”来判定;④根据复分解反应的概念、活性炭的作用、根据溶液稀释溶质质量不变来计算;⑤根据溶解度的概念.
(2)根据质量守恒定律来书写;
(3)根据质量守恒定律反应前后原子个数相等来回答;
(4)①根据过滤的原理、方法回答;②根据酸碱中和反应的原理③根据“用70~80℃热水洗涤,反复多次,直至盐分除净”来判定;④根据复分解反应的概念、活性炭的作用、根据溶液稀释溶质质量不变来计算;⑤根据溶解度的概念.
解答:解:(1)根据化学性质的概念可确定;故答案为:化学;
(2)C6H8O7在氧气中完全燃烧可确定生成物为水和二氧化碳;故答案为:2C6H8O7+9O2
8H2O+12CO2
(3)根据质量守恒定律反应前后原子个数相等;故答案为:O2
(4)①因是不溶性固体与液体的分离;故答案为:过滤;
②根据中和反应中氢离子与氢氧根离子的个数相等来配平;故答案为:2H3R+3Ca(OH)2=Ca3R2+6H2O
③因是热水把盐分洗净故该盐分受温度影响较大;故答案为:a
④因是盐与酸发生的反应、活性炭具有吸附性;根据溶液稀释溶质质量不变,可计算出需要98%的浓硫酸的体积为:5000g×35%÷98%÷1.84g/mL═970.5mL;故答案为:复分解反应、活性炭、970.5;
⑤某温度下,物质的溶解度是不变的;故答案为:bd
故答为:(1)化学;
(2)2C6H8O7+9O2
8H2O+12CO2;
(3)O2;
(4)①过滤;②2H3R+3Ca(OH)2=Ca3R2+6H2O;③a;④复分解反应、活性炭、970.5;⑤bd;
(2)C6H8O7在氧气中完全燃烧可确定生成物为水和二氧化碳;故答案为:2C6H8O7+9O2
| ||
(3)根据质量守恒定律反应前后原子个数相等;故答案为:O2
(4)①因是不溶性固体与液体的分离;故答案为:过滤;
②根据中和反应中氢离子与氢氧根离子的个数相等来配平;故答案为:2H3R+3Ca(OH)2=Ca3R2+6H2O
③因是热水把盐分洗净故该盐分受温度影响较大;故答案为:a
④因是盐与酸发生的反应、活性炭具有吸附性;根据溶液稀释溶质质量不变,可计算出需要98%的浓硫酸的体积为:5000g×35%÷98%÷1.84g/mL═970.5mL;故答案为:复分解反应、活性炭、970.5;
⑤某温度下,物质的溶解度是不变的;故答案为:bd
故答为:(1)化学;
(2)2C6H8O7+9O2
| ||
(3)O2;
(4)①过滤;②2H3R+3Ca(OH)2=Ca3R2+6H2O;③a;④复分解反应、活性炭、970.5;⑤bd;
点评:本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.此题考查了我们生活中的化学,需要同学们在生活中注意观察分析.

练习册系列答案
相关题目



