题目内容
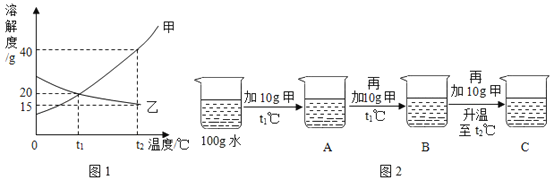
【题目】某种手机电路板中含有Fe、Cu、Au、Ag、Ni(镍,银白色金属)等金属,如下是某工厂回收部分金属的流程图。已知:2Cu+O2+2H2SO4![]() 2CuSO4+2H2O
2CuSO4+2H2O
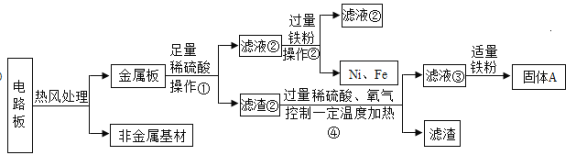
(1)操作①的名称是____________________。
(2)写出滤液②中金属阳离子符号____________________。
(3)写出滤液③和铁粉发生反应的一个化学方程式____________________________。
(4)Cu、Ag、Ni在溶液中的活动性由强到弱的顺序依次是____________________。
【答案】 过滤 Fe2+ Fe+CuSO4=FeSO4+Cu(或Fe+H2SO4=FeSO4 +H2↑) Ni Cu Ag
【解析】(1)操作①将固液分离,故是过滤;
(2)固体中的镍和铁与稀硫酸反应生成硫酸镍和硫酸亚铁,过量的铁粉与硫酸镍反应生成镍和硫酸亚铁,故滤液2是硫酸亚铁溶液,阳离子是Fe2+;
(3)滤液3是铜、氧气和硫酸反应生成硫酸铜溶液,其中含有过量的稀硫酸,故加入铁后铁可以与硫酸铜反应生成铜和硫酸亚铁或铁与稀硫酸反应生成硫酸亚铁和氢气,故反应方程式为Fe+CuSO4=FeSO4+Cu(或Fe+H2SO4=FeSO4 +H2↑);
(4)Cu、Ag、Ni在溶液中的活动性由强到弱的顺序依次是Ni、Cu、Ag。

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案【题目】某化学兴趣小组对“NaOH溶液与稀硫酸是否恰好完全反应”进行探究.请你参与他们的探究活动,并回答有关问题.
(实验探究)
(1)方案一:某同学按如图所示的方法先向试管中加入约2mL NaOH溶液,再滴入几滴酚酞溶液,溶液变红色.然后慢慢滴入稀硫酸,边滴边振荡,直至溶液恰好变为______色,证明NaOH溶液与稀硫酸恰好完全反应.
![]()
①请指出如图操作中的错误______.
②写出NaOH溶液与稀硫酸反应的化学方程式______.
(2)方案二:
实验步骤 | 实验现象 | 结论 |
取2mLNaOH溶液于试管中,滴入一定量的稀硫酸,振荡后加入镁条 | 若 ______ | 稀硫酸过量 |
若没有现象 | NaOH溶液与稀硫酸恰好完全反应 |
(实验反思)
(3)方案一在滴入稀硫酸的过程中,若观察到曾有少量气泡出现,请分析产生气泡的原因可能是______(写出一条即可).
(4)有同学提出方案二不能证明NaOH溶液与稀硫酸恰好完全反应,其原因是______.为此,还需要选择______(填一种试剂),再进行实验即可.
(拓展应用)
(5)请举一例说明中和反应在生产生活中的应用______.