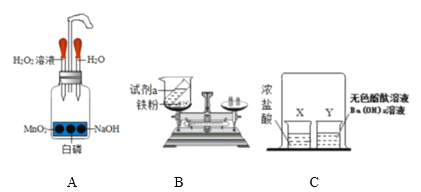
题目内容
【题目】铁、铬、锰三金属及其它们的合金,在工业上统称为“黑色金属”。其实是因为它们固体表面常覆盖一层黑色的氧化物。所以我们在实验室见到的MnO2是黑色粉末。根据下列反应:
(1)MnO2+4HCl=MnCl2+2x+Cl2↑,则X的化学式为____________。在初中化学中也可以用MnO2与一种无色液体作用产生氧气。
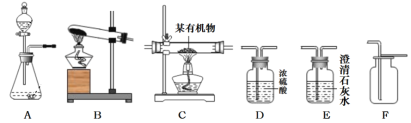
(2)现有下列一些仪器:
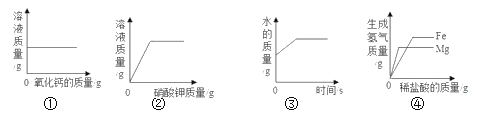
回答:不可能用到的仪器是___________;只需要___________的组合就能组装成该实验制氧气的发生装置。
【答案】H2O 2 6和7
【解析】
(1) MnO2+4HCl=MnCl2+2x+Cl2↑,根据质量守恒定律,反应前后原子的种类和数目不变,可知X的化学式为H2O;
(2)二氧化锰与过氧化氢制取氧气是不需要加热的,不可能用到的仪器是2;只需要6和7的组合就能组装成该实验制氧气的发生装置。

【题目】某化学兴趣小组同学往NaOH溶液中滴加无色酚酞溶液时,发现溶液变成红色,可是过了一会儿红色消失,重新恢复为无色。于是该小组在老师指导下对这一现象进行了探究。
(提出问题)溶液的红色为什么会变成无色呢?
(猜想与假设)
猜想一:可能是所用的酚酞溶液变质了
猜想二:可能是NaOH与空气中的CO2反应了
猜想三:可能是酚酞与空气中的O2反应了
猜想四:可能是与NaOH溶液浓度大小有关
(查阅资料)Na2CO3俗称纯碱,是一种发酵剂, Na2CO3溶液的pH值通常约为10~11.9
(讨论交流)
(1)写出氢氧化钠在空气中变质的化学方程式:__________ 。
(2)对于猜想一,大家认为是错误的。往氢氧化钠溶液中滴加酚酞溶液时,发现溶液变成了红色,说明所用酚酞没变质。
(3)小组同学集体讨论后认为猜想二 ______(填“合理”或“不合理”),原因是______。
(设计并实验)
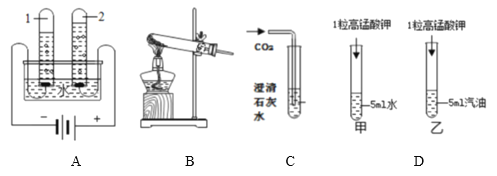
(1)为了验证猜想三,小组同学进行了如下实验:先向如图装有该NaOH溶液的试管中,从b处通入密度比空气大的稀有气体,将试管内的空气排尽。然后通过注射器滴入无色酚酞溶液,观察到溶液变成红色,过一会儿红色仍然消失。则猜想三______(填“正确”或“错误”)。

(2)为了验证猜想四,小组同学继续进行实验探究,并得出了实验结论,请你帮助该小组完成下表:
实验操作 | 实验现象 | 实验结论 |
在两支同样大小的试管中,分别加入等体积的质量分数为5%的氢氧化钠溶液和10%的氢氧化钠溶液,然后分别滴加1﹣2滴酚酞试液; | 5%的氢氧化钠溶液中红色不消失,10%的氢氧化钠溶液中先变红色,然后红色消失 | 猜想四__ (填“正确”或“错误”) |
(拓展延伸)
小组同学百度“酚酞”得知,酚酞(用H2In表示)其实是一种极弱的酸,遇碱溶液变红的变化可表示为:H2In(无色)![]() In2-(红色),据此信息写出H2In遇NaOH溶液变红的化学反应方程式为_____________。
In2-(红色),据此信息写出H2In遇NaOH溶液变红的化学反应方程式为_____________。
【题目】为了测定实验室某生锈铁片中铁元素的质量分数,两位同学分别设计了如下甲、乙两个实验方案。方案甲:称得生锈铁片的质量为 m1g,按图 I 所示装置进行实验。完全反应后,测得室温下产生氢气的体积为 V1L,查得其密度为p1g/L。方案乙:称得生锈铁片的质量为 m2g,先按图Ⅱ所示装置进行实验。当生锈铁片完全变成光亮的银白色时,停止加热,继续通入CO至室温。取出铁片,按图 I 所示装置继续进行实验。完全反应后,测得室温下产生氢气的体积为 V2L,查得其密度为 p2g/L。
已知:Fe2O3+6HCl=2FeCl3+3H2O(FeCl3可溶于水)
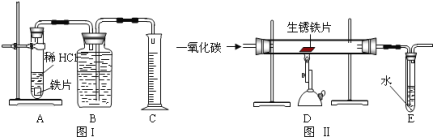
(1)铁锈的成分是__________.
(2)(评价交流)上述两个方案中,可行的是____(填“甲”或“乙”);分析不可行方案,其缺陷是____________________。
(3)(设计实验)方案乙中,同学们设计了如下实验报告,请帮助完成表中空格。
实验编号 | 实验步骤 | 实验现象 | 结论或化学方程式 |
①装置Ⅱ | 通入CO,加热.完全反应后,停止加热,继续通CO至室温 | 生锈铁片变成光亮的银白色 | CO具有______性; 化学方程式:_______ |
②装置Ⅰ | 将光亮铁片放入稀盐酸中,完全反应 | ______ |
(4)图Ⅱ所示装置有缺陷,应如何改进__________。
(5)(结论)生锈铁片中铁元素的质量分数是_________(用字母表示)。
(6)(发散)实验室经常用一氧化碳来炼铁,实验室炼的铁和工业炼的铁本质区别是_______________