题目内容
【题目】某学习小组探究气体的制备方法。
[实验可用药品探究]
(1)制取氧气时,甲同学提出,必须要用含有氧元素的物质才有可能制取氧气。他依据的原理是____ 定律
(2)工业上一般选用空气为原料制取氧气,这种方法的优点是___________________。 由于需要高压和低温条件,这种方法不适合于实验室制取氧气。
(3)下列方法中,适合实验室制取氧气的是____________;
①电解水
②加热高锰酸钾
③加热氯酸钾和二氧化锰
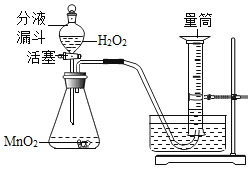
④用过氧化氢溶液和二氧化锰
⑤加热氧化汞
(4)[催化剂和催化作用探究]
[探究一] 影响过氧化氢分解速率的因素有哪些?小组同学做了四个实验,实验数据如下:
实验序号 | H2O2溶液的溶质质量的分数% | H2O2溶液的体积/mL | 温度/°C | MnO2的用量/g | 收集O2的体积/mL | 反应时间 |
① | 5 | 1 | 20 | 0.1 | 4 | 16s |
② | 15 | 1 | 20 | 0.1 | 4 | 6s |
③ | 30 | 5 | 35 | 0 | 4 | 98min |
④ | 30 | 5 | 55 | 0 | 4 | 20min |
③④两组实验对比可知:____________________________;
(5)能说明过氧化氢的分解速率与其质量分数有关的实验是____ ( 填实验序号)。
(6) [探究二] 其他金属氧化物能否起到类似MnO2的催化作用?实验方案如下:
I. 用MnO2、CuO、 Fe2O3、 Cr2O3 四种催化剂分别与海藻酸钠溶液混合,滴入氯化钙溶液制成含等质量催化剂、大小相同的海藻酸钠微球,备用。
Ⅱ.取30粒含MnO2的海藻酸钠微球,采用下图装置进行实验。改用其他三种微球,分别重复上述实验,得到下图的锥形瓶内压强随时间变化的曲线图。
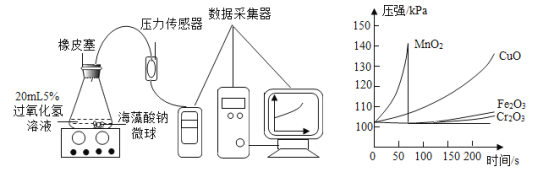
用含MnO2的海藻酸钠微球进行实验, 60 s时压强瞬间回落,其原因是______
A MnO2被反应完
B 开始实验时装置气密性不好
C 橡胶塞被气体冲出
D 数据采集器的电源被切断
(7)从实验曲线看,催化效果较好、反应温和的催化剂是____________________________。
【答案】质量守恒 来源广,价格便宜 ②③④ 温度越高,过氧化氢分解越快 ①和② CD 氧化铜
【解析】
(1)制取氧气时,甲同学提出,必须要用含有氧元素的物质才有可能制取氧气。他依据的原理是质量守恒定律,故填:质量守恒;
(2)工业上一般选用空气为原料制取氧气,这种方法的优点是来源广,价格便宜。 由于需要高压和低温条件,这种方法不适合于实验室制取氧气。故填:来源广,价格便宜;
(3)①电解水制取成本高,不适合实验室制取氧气;
②加热高锰酸钾制取氧气,条件是加热,适合实验室制氧气;
③加热氯酸钾和二氧化锰条件是加热,适合实验室制氧气;
④用过氧化氢溶液和二氧化锰条件是常温,适合实验室制氧气;
⑤氧化汞加热生成的汞有毒,不适合实验室制取氧气;
故选:②③④;
(4)[催化剂和催化作用探究]
③④两组实验对比可知:温度越高,过氧化氢分解越快,故填:温度越高,过氧化氢分解越快;
(5)能说明过氧化氢的分解速率与其质量分数有关的实验是①和②,故填:①和②;
(6)用含MnO2的海藻酸钠微球进行实验, 60 s时压强瞬间回落,其原因是橡胶塞被气体冲出、数据采集器的电源被切断。故选:CD;
(7)从实验曲线看,催化效果较好、反应温和的催化剂是氧化铜,故填:氧化铜。

【题目】25℃时,探究某固体物质的溶解性,实验记录如下表。下列实验结论正确的是
编号 | ① | ② | ③ | ④ |
水的质量/g | 50 | 50 | 50 | 50 |
加入固体质量/g | 5 | 10 | 15 | 20 |
充分溶解后 | 固体完全溶解 | 固体完全溶解 | 剩余少量固体 | 剩余较多固体 |
A.实验①所得溶液溶质质量分数为10%B.实验说明25℃时该物质的溶解度是20
C.实验③④所得溶液溶质质量分数相同D.实验④所得溶液中含溶质20g