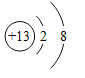题目内容
【题目】在宏观、微观和符号之间建立联系是化学学科的特点。
(1)工业上生产尿素[ CO(NH2 )2 ] 的反应微观示意图如下:
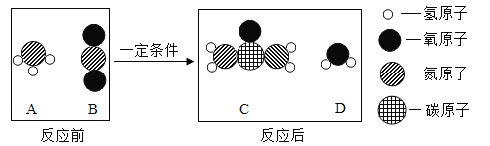
①从微观角度看,上图中四种物质都是由__________构成;
②从宏观的角度看,上图四种物质中属于氧化物的有_____________ ( 填字母序号);
③写出工业上生产尿素的化学方程式_____________。
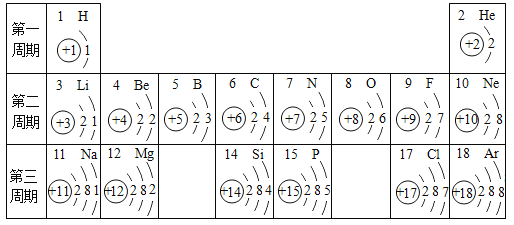
(2)下表是元素周期表中第2、3周期的元素,请回答有关问题。
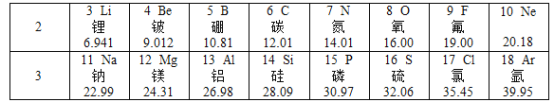
①下列各组具有相似化学性质的元素是________(填字母序号);
ANa、Cl BO、S CF、C1 DCl、Ar
②写出一条第三周期元素原子的核外电子排布规律___________;
③第7号元素与第12号元素的原子形成化合物的化学式为_________;
④某粒子的结构示意图为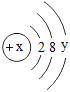 当x-y=8时,该粒子的符号为__________;
当x-y=8时,该粒子的符号为__________;
⑤具有相同原子数和电子数的分子或离子叫等电子体,等电子体具有相似的结构和性质。下列各组粒子中属于等电子体的是________(填字母序号)。
ANO和O2 BCO和 N2 CSO2和 CO2 DPO43-和SO42-
【答案】分子 BD 2NH3+CO2 CO(NH2)2+H2O BC 同一周期的元素的原子,核外电子层数相同 Mg3N2 S2- BD
CO(NH2)2+H2O BC 同一周期的元素的原子,核外电子层数相同 Mg3N2 S2- BD
【解析】
(1)①由物质的微观构成可知,图中四种物质都是由分子构成;故填:分子;
②据图可以看出,B表示的是二氧化碳,D表示的是水,二氧化碳和水属于氧化物。故填:BD;
③据图可以看出,A是氨气,B是二氧化碳,C是尿素,D是水,所以工业上生产尿素的化学方程式是:2NH3+CO2 CO(NH2)2+H2O。故填:2NH3+CO2
CO(NH2)2+H2O。故填:2NH3+CO2 CO(NH2)2+H2O。
CO(NH2)2+H2O。
(2)①具有相似化学性质的元素则最外层电子数相同,在元素周期表中位于同一族;
A.Na和Cl不是同一族,不具有相似的化学性质,故错误;
B.O和S是同一族,具有相似的化学性质,故正确;
C.F和Cl是同一族,具有相似的化学性质,故正确;
D.Cl和Ar不是同一族,不具有相似的化学性质,故错误;
故填:BC;
②第三周期元素原子的核外电子排布规律:由左至右最外层电子数依次递增或核外电子层数都是3层。故填:由左至右最外层电子数依次递增;
③第7号元素与第12号元素的原子形成化合物是氮化镁,氮化镁中镁元素化合价显+2,氮元素化合价显-3,根据化合物中元素化合价代数和为零可知,氮化镁的化学式是Mg3N2。故填:Mg3N2;
④某粒子的结构示意图为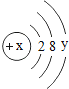 ,x-y=8,即y=x-8;由此可以看出核外电子数为2+8+(x-8)=x+2,核外电子数比核内质子数多2,则依据形成离子的特点,故x=16,y=8,该粒子为硫离子,符号为S2-。故填:S2-;
,x-y=8,即y=x-8;由此可以看出核外电子数为2+8+(x-8)=x+2,核外电子数比核内质子数多2,则依据形成离子的特点,故x=16,y=8,该粒子为硫离子,符号为S2-。故填:S2-;
⑤根据原子序数=质子数=核外电子数。
A、氧原子的核外电子数为8,氮原子的核外电子数为7,所以一氧化氮和氧气的电子数分别是15和16,不属于等电子体;
B、碳、氮、氧原子的核外电子数分别为6、7、8,由于一氧化碳和氮气的原子个数都为2,核外电子个数都为14,属于等电子体;
C、碳、氧、硫原子的核外电子数分别为6、8、16,所以二氧化硫和二氧化碳的电子数分别是32和22,不属于等电子体;
D、氧、磷、硫原子的核外电子数分别为8、15、16,磷酸根(PO43-)和和硫酸根(SO42-)的原子个数都为5,磷酸根带三个单位负电荷,其的核外电子数为15+16×4+3=82个,硫酸根带两个单位负电荷,其的核外电子数为16+16×4+2=82个,电子个数相等,属于等电子体。
故选:BD。