题目内容
【题目】下列四个坐标图分别表示实验过程中某些量的变化,其中正确的是
A. 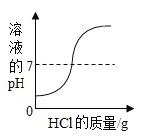 向一定体积的氢氧化钠溶液中逐滴加入稀盐酸
向一定体积的氢氧化钠溶液中逐滴加入稀盐酸
B. 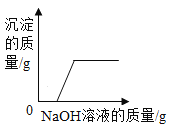 向硫酸和硫酸铜的混合溶液中滴加氢氧化钠溶液
向硫酸和硫酸铜的混合溶液中滴加氢氧化钠溶液
C. 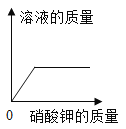 一定温度下,向不饱和的硝酸钾溶液中加入硝酸钾
一定温度下,向不饱和的硝酸钾溶液中加入硝酸钾
D. 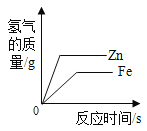 等质量的锌粉和铁粉与足量同浓度的稀盐酸反应
等质量的锌粉和铁粉与足量同浓度的稀盐酸反应
【答案】B
【解析】
A、向氢氧化钠溶液中加入盐酸溶液时,溶液的pH从大于7,逐渐降低到小于7,图像与事实不相符,故A错误;
B、向硫酸铜和硫酸的混合溶液中滴加氢氧化钠,首先是氢氧化钠与硫酸反应,无沉淀出现,当硫酸消耗完,硫酸铜与氢氧化钠反应生成氢氧化铜沉淀,图像与事实相符,故B正确;
C、在一定温度下,向不饱和的硝酸钾溶液中加入硝酸钾固体,溶液质量不会是从零开始,图像与事实不相符,故C错误;
D、锌比铁活泼,与稀盐酸反应时,锌比铁反应剧烈;根据锌粉和铁粉与足量同浓度的稀盐酸反应生成氢气的质量关系:![]() ,
, ![]() 可知,等质量的锌和铁与足量的稀盐酸反应时,锌与稀盐酸反应生成的氢气比铁少,图像与事实不相符,故D 错误。故选B。
可知,等质量的锌和铁与足量的稀盐酸反应时,锌与稀盐酸反应生成的氢气比铁少,图像与事实不相符,故D 错误。故选B。

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目