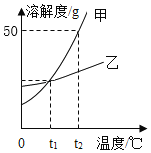
题目内容
【题目】已知:Cu2O+H2SO4═Cu+CuSO4+H2O.16.0gCuO与CO反应得到Cu、Cu2O混合物13.6g,将此混合物溶于足量的100.0g稀H2SO4中得9.6gCu.下列说法正确的是
A. 反应中生成2.4g CO2B. 混合物中氧元素与铜元素的质量比1:16
C. 混合物中含12g的铜元素D. 反应后溶液中CuSO4的质量分数约为8.0%
【答案】D
【解析】
设混合物中Cu2O的质量为x,生成硫酸铜的质量为y,则
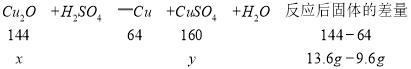
![]() ,解得x=7.2g
,解得x=7.2g
![]() ,解得y=8g
,解得y=8g
A. 16.0gCuO与CO反应得到Cu、Cu2O混合物13.6g,根据质量守恒定律,固体质量减少的质量为失去氧元素的质量,故失去氧元素的质量为:16.0-13.6g=2.4g,由于氧化铜与一氧化碳反应,生成的二氧化碳中的一半的氧元素来自氧化铜,故对应的二氧化碳的质量为:2.4g÷![]() =6.6g,此选项错误;
=6.6g,此选项错误;
B. 根据化学反应中铜元素的质量不变,故铜元素的质量为:16.0g×![]() =12.8g,混合物中氧元素的质量为:13.6g-12.8g=0.8g,故混合物中氧元素与铜元素的质量比0.8g:12.8g=16:1,此选项正确;
=12.8g,混合物中氧元素的质量为:13.6g-12.8g=0.8g,故混合物中氧元素与铜元素的质量比0.8g:12.8g=16:1,此选项正确;
C. 由以上分析可知,混合物中含12.8g的铜元素,此选项错误;
D. 反应后溶液的质量为:13.6g+100g-9.6g=104g,反应后溶液中CuSO4的质量分数为:![]() ≈7.7%,此选项错误。故选B。
≈7.7%,此选项错误。故选B。

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案【题目】某化学兴趣小组的同学,为了比较金属R与铁、铜的金属活动性强弱,进行如下探究活动。
(进行猜想)对三种金属的活动性顺序做出如下猜想。
猜想一R>Fe>Cu
猜想二:_____
猜想三:Fe>Cu>R
(收集证据)为了验证哪一种猜想成立,甲、乙、丙三位同学分别展开实验探究。
主要操作 | 主要现象 | 实验结论 | |
甲 | 将打磨好的R丝插入盛有硫酸铜溶液的试管中 | _____ | 猜想一 正确 |
乙 | 将粗细相同打磨好的R丝、铁丝,分别插入体积和溶质质量分数都相同的稀盐酸中 | R丝表面产生气泡速率比铁丝表面产生气泡速率_____(填“快”或“慢”) | |
丙 | 将粗细相同打磨好的R丝、铁丝,分别在空气中点燃 | R丝在空气中剧烈燃烧,铁丝在 空气中不燃烧 |
写出R与盐酸反应化学方程式_____(R的化合价+2)
(交流反思)三位同学交流讨论后认为,比较金属活动性强弱的方法有多种。
(归纳总结)他们总结得出比较金属活动性强弱的常见方法有:
(1)金属与氧气反应的难易和剧烈程度;
(2)金属与_____是否反应或反应的剧烈程度;
(3)金属与_____是否反应。